
Wetenschap
Hoeveel gram CO2 worden gebruikt wanneer 8.0G O2 wordt geproduceerd?
1. Evenwichtige chemische vergelijking:
De reactie die u beschrijft, is de verbranding van een koolstofhoudende verbinding (zoals een koolwaterstof) om koolstofdioxide (CO2) en water (H2O) te produceren. Omdat we alleen om de zuurstof- en koolstofdioxide geven, kunnen we de vergelijking vereenvoudigen:
C + O2 → CO2
2. Mol -verhoudingen:
De gebalanceerde vergelijking laat zien dat 1 mol O2 1 mol CO2 produceert.
3. Molaire massa:
* De molaire massa O2 is 32 g/mol (16 g/mol voor elk zuurstofatoom).
* De molaire massa CO2 is 44 g/mol (12 g/mol voor koolstof en 32 g/mol voor zuurstof).
4. Berekening:
* Stap 1: Bereken de mol O2:
mol O2 =massa O2 / molaire massa van O2 =8,0 g / 32 g / mol =0,25 mol
* Stap 2: Omdat de molverhouding van O2 tot CO2 1:1 is, heb je 0,25 mol CO2 geproduceerd.
* Stap 3: Bereken de massa CO2:
Massa van CO2 =mol CO2 * molaire massa van CO2 =0,25 mol * 44 g/mol =11 g
Antwoord: 11 gram CO2 worden gebruikt wanneer 8,0 gram O2 wordt geproduceerd.
 NIST pH-standaardreferentiematerialen ondersteunen een van de meest gemeten eigenschappen van de productie
NIST pH-standaardreferentiematerialen ondersteunen een van de meest gemeten eigenschappen van de productie Nieuwe inzichten in het faalmechanisme van lithium-ionbatterijen
Nieuwe inzichten in het faalmechanisme van lithium-ionbatterijen Wat is de verzameling kleine waterdruppeltjes in de atmosfeer?
Wat is de verzameling kleine waterdruppeltjes in de atmosfeer?  Kunt u in Canada een distributeur van onderzoekschemicaliën opzetten die legale chemicaliën verkoopt?
Kunt u in Canada een distributeur van onderzoekschemicaliën opzetten die legale chemicaliën verkoopt?  Hoe je roest reinigt uit een gootsteenafvoer rond een flens
Hoe je roest reinigt uit een gootsteenafvoer rond een flens
 Nieuw-Zeelandse rivier erkend als rechtspersoon
Nieuw-Zeelandse rivier erkend als rechtspersoon De effecten van microplastics op organismen in kustgebieden
De effecten van microplastics op organismen in kustgebieden Alpentoppen waren mogelijk ijsvrij tijdens het leven van de Tiroler Iceman
Alpentoppen waren mogelijk ijsvrij tijdens het leven van de Tiroler Iceman Waarom het verbieden van wandelingen naar de hoogste boom ter wereld nooit zal werken
Waarom het verbieden van wandelingen naar de hoogste boom ter wereld nooit zal werken  Driekwart van Australiërs getroffen door zomerbosbranden
Driekwart van Australiërs getroffen door zomerbosbranden
Hoofdlijnen
- Zelfverdedigingsstrategieën van mos:scheikundigen ontdekken wat de eetlustslakken bederft
- Nieuwe genetische variatie van oude en exotische variëteiten voor milieuvriendelijke tarweteelt
- Wetenschappers bieden nieuw inzicht in de manier waarop bacteriën resistentiegenen tegen geneesmiddelen delen
- De kleur van de evolutie:hoe één vis twee werd
- Hoe cellen door het plakkerigste slijm heen ritsen
- Wat is de oorsprong van amylase?
- Hoe beïnvloedt het plastic vissen?
- Wat is de medische term die compressie van omliggende cellen betekent door tumorcellen?
- Waarom kan de bacterie nu insuline maken?
- Tweaks achter de wedergeboorte van bijna afgedankte organische zonnetechnologieën

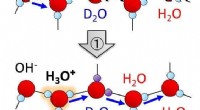
- Unieke structurele fluctuaties aan het ijsoppervlak bevorderen auto-ionisatie van watermoleculen
- Daglichtschadebesparende tijd

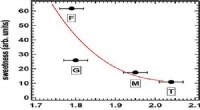
- Water kan de sleutel zijn tot het begrijpen van zoetheid
- Optische microscoopstrategie stelt waarnemers in staat elektronen te controleren die in goud bewegen

 Wanneer is de totale mechanische energie geconserveerd?
Wanneer is de totale mechanische energie geconserveerd?  Beschrijf de soorten fossielen
Beschrijf de soorten fossielen Hoe de Russische online censuur de internetvrijheid wereldwijd in gevaar kan brengen
Hoe de Russische online censuur de internetvrijheid wereldwijd in gevaar kan brengen Hoe een miniatuur San Fernando Rey Mission
Hoe een miniatuur San Fernando Rey Mission Hoe kunnen de oplosbaarheidsregels helpen het product van een reactie te voorspellen?
Hoe kunnen de oplosbaarheidsregels helpen het product van een reactie te voorspellen?  Metaalcoördinatie maakt hoge temperatuur, kruipvast polyimine vitrimeer preparaat
Metaalcoördinatie maakt hoge temperatuur, kruipvast polyimine vitrimeer preparaat Vermijd de politiek en laat kunstmatige intelligentie uw stem bepalen bij de volgende verkiezingen
Vermijd de politiek en laat kunstmatige intelligentie uw stem bepalen bij de volgende verkiezingen Knaagdieren op het Iberisch schiereiland migreerden twaalf miljoen jaar geleden als gevolg van klimaatverandering
Knaagdieren op het Iberisch schiereiland migreerden twaalf miljoen jaar geleden als gevolg van klimaatverandering
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

