
Wetenschap
Welk patroon zit in een edel gas?
Hier is de uitsplitsing:
* Volledige buitenste schaal: Nobele gassen zijn uniek omdat ze een volledig gevulde buitenste elektronenschaal hebben . Dit maakt ze extreem stabiel en niet -reactief.
* octetregel: De meeste edelgassen volgen de octetregel , wat betekent dat ze acht elektronen in hun buitenste schaal hebben (behalve helium, die er twee heeft).
* Elektronenconfiguratie: De elektronenconfiguratie van edelgassen eindigt met een p⁶ configuratie. Bijvoorbeeld:
* Helium:1S²
* Neon:1S² 2S² 2P⁶
* Argon:1S² 2S² 2P⁶ 3S² 3P⁶
* Krypton:1S² 2S² 2P⁶ 3S² 3P⁶ 4S² 3D¹⁰ 4P⁶
Deze stabiele elektronenconfiguratie is de belangrijkste reden waarom nobele gassen zeer niet -reactief zijn.
Hier is hoe dit patroon zich verhoudt tot de periodiek systeem:
* Groep 18: Nobele gassen bezetten groep 18 van het periodiek systeem. Deze plaatsing benadrukt hun gedeelde kenmerk van het hebben van een volledige buitenste schaal.
* reactiviteitstrend: Terwijl u het periodiek systeem afneemt, worden de edelgassen iets reactiever. Dit komt door grotere atoomstralen en zwakkere aantrekkingskracht tussen de kern en de buitenste elektronen.
Laat het me weten als je wilt dat ik een specifiek aspect van dit patroon uitgewerkt!
 Een emissiespectrum van een atoom wordt geproduceerd wanneer de elektronen zijn.
Een emissiespectrum van een atoom wordt geproduceerd wanneer de elektronen zijn.  Welke gassen staan op het periodiek systeem?
Welke gassen staan op het periodiek systeem?  Wat is de chemische formule van ontsmettingsalcohol ispropyl?
Wat is de chemische formule van ontsmettingsalcohol ispropyl?  Wat is de molaire massa van aluminiumnitride?
Wat is de molaire massa van aluminiumnitride?  Wetenschappers zetten de oplossing in een oplosmiddel voor de uitdaging van lithium-zwavelbatterijen
Wetenschappers zetten de oplossing in een oplosmiddel voor de uitdaging van lithium-zwavelbatterijen
 Een nieuwe kijk op (afval)water en milieubehoud
Een nieuwe kijk op (afval)water en milieubehoud NASA volgt tyfoon Kalmaegi die Noord-Filippijnen treft
NASA volgt tyfoon Kalmaegi die Noord-Filippijnen treft Kansen die cruciaal zijn voor het snijden van Chesapeake-voedingsstoffen, sedimentbelastingen
Kansen die cruciaal zijn voor het snijden van Chesapeake-voedingsstoffen, sedimentbelastingen Afbeelding:Schoenmakerkrater, Australië
Afbeelding:Schoenmakerkrater, Australië Libellen laten zien hoe de biodiversiteit verandert in tijd en ruimte
Libellen laten zien hoe de biodiversiteit verandert in tijd en ruimte
Hoofdlijnen
- Wat zijn de verschillende soorten celtransport?
- Wat voor soort pigment is Clorophyll?
- Grootste genetische studie van muggen onthult verspreiding van resistentie tegen insecticiden in Afrika
- Wetenschappers presenteren een nieuwe methode om elk eiwit in elk soort cel direct en snel te vernietigen
- De adder-nabootsende slang uit Azië is een unieke tak in de evolutionaire boom van reptielen
- Hoe Charles Darwin werkte
- Naam 2 celorganellen met DNA?
- Waarom bevatten niet alle plantencellen chloroplasten?
- Wat doodde de dinosaurussen?
- Nieuw, vereenvoudigde techniek maakt licht metalen nanofoam

- Ultrasnelle lasers onderzoeken ongrijpbare chemie op het vloeistof-vloeistofgrensvlak

- Onderzoekers onderzoeken mogelijke behandeling voor mitochondriale ziekten
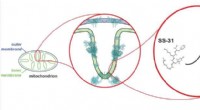
- Vraagtekens bij het verband tussen vervuiling door magnetietdeeltjes en de ziekte van Alzheimer

- Nieuwe test biedt nauwkeurige meting van DNA-schade door chemische verbindingen

 Hoeveel liter bloed bevat het menselijk lichaam?
Hoeveel liter bloed bevat het menselijk lichaam?  Bloeddruk e-tattoo belooft continue, mobiele monitoring
Bloeddruk e-tattoo belooft continue, mobiele monitoring Betekenen vrachtwagens Trump? AI laat zien hoe mensen afbeeldingen verkeerd beoordelen
Betekenen vrachtwagens Trump? AI laat zien hoe mensen afbeeldingen verkeerd beoordelen Wetenschappers onderzoeken hoe olie de kleinste organismen in Antarctische wateren beïnvloedt
Wetenschappers onderzoeken hoe olie de kleinste organismen in Antarctische wateren beïnvloedt Welke soorten organismen voeren de ademhaling uit?
Welke soorten organismen voeren de ademhaling uit?  Krachtige tropische cycloon Veronica kijkt naar de Australische kust van Pilbara
Krachtige tropische cycloon Veronica kijkt naar de Australische kust van Pilbara Hoe verwarm je vloeistof in een beker?
Hoe verwarm je vloeistof in een beker?  Roest van ijzer is een langzame verbranding van het type?
Roest van ijzer is een langzame verbranding van het type?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

