
Wetenschap
Roest van ijzer is een langzame verbranding van het type?
* oxidatie: Roestend is in wezen de oxidatie van ijzer. Zuurstof uit de lucht reageert met het ijzer en vormt ijzeroxide (roest). Deze reactie geeft energie vrij, net als verbranding.
* exotherme reactie: Het roestproces is exotherme, wat betekent dat het warmte vrijgeeft, hoewel de geproduceerde warmte erg klein is en vaak snel verdwenen is.
* Soortgelijk chemisch proces: Het fundamentele chemische proces op het werk in zowel roest en verbranding is oxidatie, waarbij een stof combineert met zuurstof. In beide gevallen worden elektronen overgebracht van het ijzer of de brandstof naar de zuurstof.
Waarom roesten langzamer is:
* Langzame reactiesnelheid: Rusten is een veel langzamere reactie in vergelijking met de snelle verbranding van brandstof. Dit komt omdat het reactieoppervlak beperkt is en de zuurstofmoleculen moeten diffunderen door een roestlaag die zich op het oppervlak van het ijzer vormt.
* afwezigheid van vlam: In tegenstelling tot verbranding waar een vlam zichtbaar is, is roest een geleidelijk proces zonder een merkbare vlam.
Conclusie:
Hoewel roesten geen zichtbare vlam of snelle warmteafgifte inhoudt, zoals typische verbranding, is het onderliggende chemische proces fundamenteel hetzelfde:oxidatie. Het is gewoon een veel langzamere en minder dramatische vorm ervan.
 Is kalkwater een zuur, alkalisch of neutraal?
Is kalkwater een zuur, alkalisch of neutraal?  Een experiment voorgesteld door een Ph.D. student mag scheikundeboeken herschrijven
Een experiment voorgesteld door een Ph.D. student mag scheikundeboeken herschrijven Waarom wordt zeewater gezouten?
Waarom wordt zeewater gezouten?  Wetenschappers ontwikkelen een biologisch afbreekbare legering voor botimplantaten voor fracturen, osteoporose en myeloom
Wetenschappers ontwikkelen een biologisch afbreekbare legering voor botimplantaten voor fracturen, osteoporose en myeloom Wanneer een mineraal op ruw oppervlak wordt gewreven, verlaat het Syreak of Luster?
Wanneer een mineraal op ruw oppervlak wordt gewreven, verlaat het Syreak of Luster?
 Wat de droogte in Kaapstad andere steden kan leren over klimaatadaptatie
Wat de droogte in Kaapstad andere steden kan leren over klimaatadaptatie Welke vijanden hebben wasberen?
Welke vijanden hebben wasberen?  Illegale houtkap op steile hellingen brengt levens in gevaar
Illegale houtkap op steile hellingen brengt levens in gevaar Wortelexsudaten beïnvloeden de bodemstabiliteit, waterafstotendheid
Wortelexsudaten beïnvloeden de bodemstabiliteit, waterafstotendheid U of A-studenten willen plastic afval verminderen met op hennep gebaseerde producten voor vrouwelijke hygiëne
U of A-studenten willen plastic afval verminderen met op hennep gebaseerde producten voor vrouwelijke hygiëne
Hoofdlijnen
- Passagiersduivengenoom toont effecten van natuurlijke selectie in een enorme populatie
- Hoe T-cellen ervoor zorgen dat ze rust hebben
- Onderzoekers leveren bewijs van hoe eiwitten vouwen
- In Brazilië hoopt men AI te kunnen gebruiken om dieren in het wild te behoeden voor verkeersdoden
- Nieuw rapport vindt succes in adoptieprogramma voor wilde paarden, critici zijn het daar niet mee eens
- Nieuw boek:Hoe u kunt voorkomen dat STEM-ondersteuning tekortschiet
- Technische industriële microalgen voor het produceren van gezonde biologische olie
- Wat heeft de vorm van een peer en heeft twee genomen? Controleer de vijver
- Welke ziekten veroorzaken coccusbacteriën?
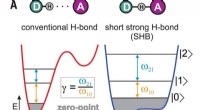
- Experimenten met bifluoride-ionen tonen bewijs van hybride bindingen
- Nieuwe bacteriële testmethode om de gezondheidszorg te verbeteren, voedselveiligheid en meer
- Een type semi-transparant polymeer dat bij kamertemperatuur kan worden hersteld met een kleine druk

- Doorbraak in het benutten van de kracht van biologische katalysatoren

- Materiaal met één elektrode stroomlijnt functies tot een kleine chip

 Facebook probeert eSports-fans te lokken met online portal
Facebook probeert eSports-fans te lokken met online portal Onderzoekers kijken naar factoren buiten het gezin die kinderverwaarlozing veroorzaken
Onderzoekers kijken naar factoren buiten het gezin die kinderverwaarlozing veroorzaken Jonge werknemers lijden langer onder recessies
Jonge werknemers lijden langer onder recessies Dit is waarom we een zwaartekrachtgolfobservatorium op de maan moeten plaatsen
Dit is waarom we een zwaartekrachtgolfobservatorium op de maan moeten plaatsen  Gemagnetiseerde plasma's die licht draaien, kunnen krachtige microscopen produceren en meer
Gemagnetiseerde plasma's die licht draaien, kunnen krachtige microscopen produceren en meer Welk voorbeeld van een metaal is roestbestendig?
Welk voorbeeld van een metaal is roestbestendig?  Hoe zijn genen, DNA en chromosomen met elkaar verbonden?
Hoe zijn genen, DNA en chromosomen met elkaar verbonden?  Gebruik van plasmonics voor precisielandbouw wereldwijd
Gebruik van plasmonics voor precisielandbouw wereldwijd
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

