
Wetenschap
Hoe zorgt een edelgas voor een niet -reactieve omgeving?
1. Elektronenconfiguratie:
* Atomen streven ernaar een stabiele elektronenconfiguratie te bereiken, vergelijkbaar met het dichtstbijzijnde edelgas. Dit betekent een volledige buitenste schaal van elektronen.
* Nobele gassen hebben al een volledige buitenste schaal. Helium (hij) heeft bijvoorbeeld 2 elektronen en vult zijn 1s orbitaal. Neon (NE) heeft 10 elektronen en vult zijn 2S en 2p orbitalen.
2. Reactiviteit en de octetregel:
* Atomen hebben de neiging om elektronen te winnen, verliezen of delen om een volledige buitenste schaal te bereiken, volgens de octetregel (behalve helium, die een volledige schaal heeft met 2 elektronen).
* Omdat edelgassen al een volledige buitenste schaal hebben, hoeven ze geen elektronen te winnen, verliezen of delen om stabiel te worden. Dit maakt hen ongelooflijk onreactief.
3. Niet -reactieve omgevingen:
* Wanneer er een edelgas aanwezig is, biedt het een niet -reactieve omgeving omdat het niet gemakkelijk deelneemt aan chemische reacties.
* Dit maakt ze ideaal voor toepassingen waarbij reactiviteit moet worden geminimaliseerd, zoals:
* behoud: Het opslaan van zeer reactieve stoffen zoals alkali -metalen.
* verlichting: Gloeilampen vullen om filamentoxidatie te voorkomen (bijv. Argon).
* lassen: Het creëren van een inerte sfeer voor het lassen (bijvoorbeeld argon).
* Medische beeldvorming: MRI -machines gebruiken helium vaak als koelvloeistof.
Samenvattend: De volledige buitenste schaal van elektronen in edelgasatomen maakt ze extreem stabiel en bestand tegen chemische reacties. Deze niet -reactieve aard biedt een beschermende omgeving voor andere stoffen.
 Nieuw onderzoek identificeert dodelijk verborgen weersgevaar dat miljoenen mensen kan treffen
Nieuw onderzoek identificeert dodelijk verborgen weersgevaar dat miljoenen mensen kan treffen Met subsidies voor fossiele brandstoffen mensheid investeert in eigen ondergang:VN-chef
Met subsidies voor fossiele brandstoffen mensheid investeert in eigen ondergang:VN-chef Federale afkeer van klimaatbeschermingsbeleid kan sommige steden energie geven, onderzoeker zegt:
Federale afkeer van klimaatbeschermingsbeleid kan sommige steden energie geven, onderzoeker zegt: Hoe zijn planten en dieren van elkaar afhankelijk?
Hoe zijn planten en dieren van elkaar afhankelijk?  De wildernis van een baai van Lake Ontario laat zien hoe kusthabitats lijden onder het veranderende klimaat, menselijke keuzes
De wildernis van een baai van Lake Ontario laat zien hoe kusthabitats lijden onder het veranderende klimaat, menselijke keuzes
Hoofdlijnen
- Welke factor is het minst waarschijnlijk bij te dragen aan een toename van de evolutiesnelheid?
- Wat zijn de abstracte zelfstandige naamwoorden voor breed en sterk?
- Onderzoekers verduidelijken hoe cellen zichzelf verdedigen tegen virussen
- Wat is Khumbi Mann Mushroom of Agaricus Campesteris?
- Wat zijn locomotaire organen in Euglena?
- Het Bohr-model:snel vervangen maar nooit vergeten
- Hoe kan het begrijpen van verkeerd gevouwen eiwitten de behandeling van ziekten helpen verbeteren?
- Welke elementen zijn van nature monatomisch?
- Noem het polymeer van koolhydraten -eiwitten lipiden en nucleïnezuur?
- Een stof in bruinkool kan virussen helpen bestrijden
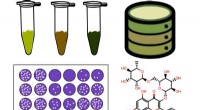
- Inzicht in 3D-structuur van enzymen kan biobrandstofkosten verlagen
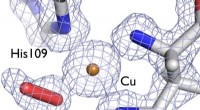
- Onderzoekers hebben bewezen dat ozon effectief is bij het desinfecteren van coronavirus

- Onderzoekers ontwikkelen groene alternatieven voor fossiele grondstoffen

- Het bouwen van Europese steden met hout zou de helft van de huidige koolstofemissies van de cementindustrie vastleggen en opslaan

 Alle Bitcoin-mijnbouw moet milieuvriendelijk zijn
Alle Bitcoin-mijnbouw moet milieuvriendelijk zijn Kolencentrales grootste vervuilers in Europa
Kolencentrales grootste vervuilers in Europa Wat is het kookpunt van een natriumchlorideoplossing?
Wat is het kookpunt van een natriumchlorideoplossing?  Hoe stroomgebieden werken
Hoe stroomgebieden werken  Britse vakbond verliest uitdaging bij Deliveroo over chauffeursstatus
Britse vakbond verliest uitdaging bij Deliveroo over chauffeursstatus Hoe worden waterstofbindingen verbroken?
Hoe worden waterstofbindingen verbroken?  Hoe een plotselinge opwarming van de stratosfeer het noordelijk halfrond beïnvloedde
Hoe een plotselinge opwarming van de stratosfeer het noordelijk halfrond beïnvloedde Eerste bemande vlucht van Boeing-ruimtevaartuig opnieuw uitgesteld
Eerste bemande vlucht van Boeing-ruimtevaartuig opnieuw uitgesteld
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

