
Wetenschap
Hoe reageren deeltjes wanneer ze veranderen van vaste stof in vloeistof en gas?
Solid State
* Nauw verpakt: Deeltjes in een vaste stof zijn strak gepakt in een vaste, geordende opstelling (zoals een kristalrooster).
* lage energie: Deeltjes hebben lage kinetische energie (beweging van de energie) en trillen iets rond hun vaste posities.
* Sterke attracties: Sterke krachten van aantrekkingskracht (zoals chemische bindingen of intermoleculaire krachten) houden de deeltjes bij elkaar.
* Vaste vorm en volume: Vaste stoffen hebben een duidelijke vorm en volume omdat de deeltjes op hun plaats zijn vergrendeld.
vloeibare toestand
* meer afstand: Deeltjes zijn dichter bij elkaar dan in een gas maar verder uit elkaar dan in een vaste stof. Ze kunnen zich verplaatsen en langs elkaar glijden.
* Hogere energie: Deeltjes hebben meer kinetische energie, waardoor ze kunnen bewegen en een deel van de attracties tussen hen kunnen overwinnen.
* Zwakkere attracties: Attracties tussen vloeibare deeltjes zijn zwakker dan in vaste stoffen, waardoor een grotere beweging mogelijk is.
* vast volume, variabele vorm: Vloeistoffen hebben een vast volume (de hoeveelheid materie) maar nemen de vorm van hun container omdat de deeltjes kunnen stromen.
Gaseous State
* wijd verdeeld: Deeltjes staan ver uit elkaar en bewegen willekeurig.
* Hoge energie: Deeltjes hebben zeer hoge kinetische energie en bewegen snel en vaak tegen elkaar botsen.
* Zeer zwakke attracties: Attracties tussen gasdeeltjes zijn erg zwak, waardoor ze zich kunnen verspreiden en hun container kunnen vullen.
* Variabele vorm en volume: Gassen nemen de vorm en het volume van hun container omdat de deeltjes vrij bewegen.
Overgang tussen staten
* smelten: Wanneer een vaste stof warmte absorbeert, krijgen deeltjes energie, trillen sterker en overwinnen enkele van de attracties die ze bij elkaar houden. Ze gaan over naar een vloeistof.
* Bevriezen: Wanneer een vloeistof warmte verliest, verliezen deeltjes energie, bewegen ze langzamer en worden de attracties tussen hen sterker, waardoor ze stollen.
* Verdamping/koken: Wanneer een vloeistof warmte absorbeert, krijgen deeltjes voldoende energie om de attracties bij elkaar te houden en te ontsnappen in de gasfase.
* condensatie: Wanneer een gas warmte verliest, verliezen deeltjes energie, vertragen en worden attracties tussen hen sterker, waardoor ze in een vloeistof condenseren.
* sublimatie: Wanneer een vaste stof warmte absorbeert, kunnen deeltjes direct overgaan naar een gas zonder een vloeistof te worden (zoals droog ijs).
* afzetting: Wanneer een gas warmte verliest, kunnen deeltjes direct overgaan naar een vaste stof zonder een vloeistof te worden.
Key Points
* De hoeveelheid energiedeeltjes bepaalt hun toestand van materie.
* De sterkte van aantrekkingskracht tussen deeltjes beïnvloedt hoe gemakkelijk ze van toestand kunnen veranderen.
* Temperatuur en druk spelen cruciale rollen in deze overgangen.
 Welk bewijs gebruikte Alfred Wegener om zijn theorie van de uiteenvallen Pangea te ondersteunen?
Welk bewijs gebruikte Alfred Wegener om zijn theorie van de uiteenvallen Pangea te ondersteunen?  Hoge resolutie, terahertz-aangedreven atoomsonde tomografie
Hoge resolutie, terahertz-aangedreven atoomsonde tomografie Is hcl een verbinding of element?
Is hcl een verbinding of element?  Wetenschappers ontdekken een lang gezochte stikstofallotroop in zwarte fosforstructuur
Wetenschappers ontdekken een lang gezochte stikstofallotroop in zwarte fosforstructuur Verrode fluorescerende zijde kan schadelijke bacteriën doden als biomedische en milieuremedie
Verrode fluorescerende zijde kan schadelijke bacteriën doden als biomedische en milieuremedie
 Uitbarsting van Okmok-vulkaan in Alaska gekoppeld aan periode van extreme kou in het oude Rome
Uitbarsting van Okmok-vulkaan in Alaska gekoppeld aan periode van extreme kou in het oude Rome Onderzoek toont aan dat beperkingen op houtverbranding in Utah de luchtkwaliteit drastisch verbeteren
Onderzoek toont aan dat beperkingen op houtverbranding in Utah de luchtkwaliteit drastisch verbeteren Onderzoek naar het risico van metaalverontreiniging in inactieve mijnen kan helpen bij terugwinningsinspanningen
Onderzoek naar het risico van metaalverontreiniging in inactieve mijnen kan helpen bij terugwinningsinspanningen Hoe gebruik je biofysica in een zin?
Hoe gebruik je biofysica in een zin?  Een nieuwe kijk op onderwaterbeelden
Een nieuwe kijk op onderwaterbeelden
Hoofdlijnen
- Hoe reproduceren algen?
- Argentijnse wetenschappers maken zich zorgen na golf van walvissterfte
- Wat zijn fagocytische granulocyten?
- Op welke twee manieren beïnvloedt de mens de stikstofcyclus?
- Genetisch gemodificeerde paarse tomaten komen mogelijk naar een Amerikaanse supermarkt bij jou in de buurt
- Wat wordt een cel geproduceerd door de Unie van gameten die identieke allelen vervoeren?
- Wat is wetenschappelijke notatie voor 420?
- Waarom delen huidcellen vaker dan andere cellen?
- Ingenieurs ontwikkelen innovatieve softwaretools voor microbioomanalyse
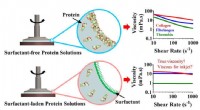
- Het vinden van vezelig eiwit kan leiden tot verbeterde bioprinting, tissue engineering
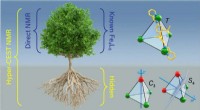
- Hyper-CEST NMR-techniek onthult ontbrekende structuur van een nieuw containermolecuul
- Stabiele perovskiet-LED's een stap dichterbij

- Een niet-destructieve methode voor het analyseren van oud-Egyptisch balsemmateriaal

- Wetenschappers ontwikkelen methode om fluorescerende biosensoren te testen voordat ze worden gesynthetiseerd

 Japanse SoftBank investeert 900 miljoen euro in Duitse Wirecard
Japanse SoftBank investeert 900 miljoen euro in Duitse Wirecard Team laat zien hoe gegevens kunnen worden opgeslagen met behulp van 2D-materialen in plaats van siliciumchips
Team laat zien hoe gegevens kunnen worden opgeslagen met behulp van 2D-materialen in plaats van siliciumchips Oost-Afrika wankelt van dodelijke overstromingen bij extreem weer
Oost-Afrika wankelt van dodelijke overstromingen bij extreem weer Grote milieu-uitdaging aangezien microplastics schadelijk zijn voor ons drinkwater
Grote milieu-uitdaging aangezien microplastics schadelijk zijn voor ons drinkwater Elektriciteitsvraag voorspellen
Elektriciteitsvraag voorspellen Is kleding een natuurlijke bodembron?
Is kleding een natuurlijke bodembron?  In welk domein zou je een nieuw ontdekt eencellig organisme classificeren met veel kleine chloroplasten?
In welk domein zou je een nieuw ontdekt eencellig organisme classificeren met veel kleine chloroplasten?  Onderbenut deel van het elektromagnetische spectrum krijgt optische boost van metamateriaal
Onderbenut deel van het elektromagnetische spectrum krijgt optische boost van metamateriaal
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

