
Wetenschap
Waarom zijn de halogenen zo reactief en edelgassen niet reactief?
halogenen:
* Elektronenconfiguratie: Halogenen (groep 17) hebben zeven valentie -elektronen (elektronen in hun buitenste schaal). Ze zijn slechts één elektron die weg zijn van het bereiken van een stabiele, volledige buitenste schaal, zoals de edelgassen.
* neiging om elektronen te winnen: Om stabiliteit te bereiken, hebben halogenen een sterke neiging om te wonen Eén elektron, die een negatief ion vormt (een anion). Dit maakt ze zeer reactief omdat ze gemakkelijk reageren met andere elementen om hun buitenste schaal te voltooien.
* Hoge elektronegativiteit: Halogenen hebben een hoge elektronegativiteit, wat betekent dat ze een sterke aantrekkingskracht hebben op elektronen. Dit draagt bij aan hun vermogen om elektronen weg te trekken van andere atomen, bindingen te vormen en deel te nemen aan reacties.
Nobele gassen:
* Elektronenconfiguratie: Nobele gassen (groep 18) hebben een complete buitenste schaal van elektronen. Dit maakt hen uitzonderlijk stabiel, omdat hun elektronenconfiguratie al in evenwicht is en weinig energie is.
* Geen neiging om elektronen te winnen of te verliezen: Omdat ze een volledige buitenschaal hebben, hoeven ze niet te worden verkregen of verliezen om stabieler te worden. Dit maakt hen uiterst onuitvoerbaar.
Samenvattend:
Halogenen zijn reactief omdat ze graag één elektron willen krijgen om een stabiele elektronenconfiguratie te bereiken. Nobele gassen zijn niet -reactief omdat ze al een stabiele elektronenconfiguratie bezitten en geen elektronen hoeven te krijgen of te verliezen.
 Ingetrokken:Paper waarin wordt beweerd dat klimaatverandering wordt veroorzaakt door de afstand tot de zon
Ingetrokken:Paper waarin wordt beweerd dat klimaatverandering wordt veroorzaakt door de afstand tot de zon Noordelijke oceanen hebben ooit CO2 de atmosfeer in gepompt
Noordelijke oceanen hebben ooit CO2 de atmosfeer in gepompt Studie identificeert atmosferische en economische oorzaken van mondiale luchtvervuiling
Studie identificeert atmosferische en economische oorzaken van mondiale luchtvervuiling  Michigan winters, zoals generaties ze hebben gekend, komt misschien een einde
Michigan winters, zoals generaties ze hebben gekend, komt misschien een einde Klimaatverandering kan lenen duurder maken voor staten en steden
Klimaatverandering kan lenen duurder maken voor staten en steden
Hoofdlijnen
- Wat zou er gebeuren als een cel geen ribosomen had?
Cellen zijn de kleinste functionele eenheden van alle levende wezens. In de cellen bevinden zich gespecialiseerde structuren, organellen genaamd, die ze helpen bepaalde functies uit te voeren. Rib
- Nieuwe tools helpen bij het zoeken naar levensverlengende chemicaliën
- Wat is het effect van prokaryote indringers?
- Onderzoek laat zien waarom ouders worden geboren en niet worden gemaakt
- Hoe meten we pijn?
- Deze reuzen zijn de zeven hoogste bomen ter wereld
- Onderzoeker probeert te begrijpen hoe gonorroe resistentie tegen antibiotica ontwikkelt
- Waarom het bestrijden van invasieve soorten een van de beste manieren is om je voor te bereiden op klimaatverandering
- Drones gebruiken om gewasschade door wilde zwijnen in te schatten
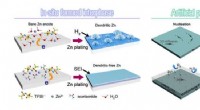
- Interfaciale chemie verbetert de oplaadbaarheid van Zn-batterijen
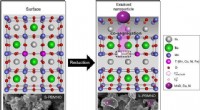
- Nieuwe koolwaterstofbrandstofcellen met hoog rendement en lage kosten
- Antibiotica-inzicht kan helpen in strijd tegen bacteriële resistentie

- Wetenschappers ontdekken nieuwe oorsprong van chemische reacties van het leven

- Een revolutionair materiaal voor ruimtevaart en neuromorfisch computergebruik

 Hoe kunnen principes worden gebruikt om menselijke eigenschappen te bestuderen?
Hoe kunnen principes worden gebruikt om menselijke eigenschappen te bestuderen?  The Prisoners Dilemma:Verkennen van een strategie die leidt tot onderlinge samenwerking zonder niet-coöperatieve acties
The Prisoners Dilemma:Verkennen van een strategie die leidt tot onderlinge samenwerking zonder niet-coöperatieve acties Waarom kunnen bepaalde Bugs op het water lopen?
Waarom kunnen bepaalde Bugs op het water lopen?  Uit onderzoek blijkt dat de kooldioxide-emissies van de Amazone rivier de opname op het land bijna in evenwicht houden
Uit onderzoek blijkt dat de kooldioxide-emissies van de Amazone rivier de opname op het land bijna in evenwicht houden Samengestelde ogen:het visuele apparaat van de hedendaagse degenkrabben gaat 400 miljoen jaar terug
Samengestelde ogen:het visuele apparaat van de hedendaagse degenkrabben gaat 400 miljoen jaar terug Flexibele ferro-elektriciteit brengt twee materiële werelden samen
Flexibele ferro-elektriciteit brengt twee materiële werelden samen Je rijdt als een meisje:onderzoek toont gendervooroordelen in percepties van ritdeelprestaties
Je rijdt als een meisje:onderzoek toont gendervooroordelen in percepties van ritdeelprestaties Leven op Mars? Wetenschappers hopen het te vinden door het DNA van Mars te decoderen
Leven op Mars? Wetenschappers hopen het te vinden door het DNA van Mars te decoderen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

