
Wetenschap
Welk molecuul heeft een dipoolmoment?
Wat is een dipoolmoment?
Een dipoolmoment is een maat voor de scheiding van positieve en negatieve ladingen binnen een molecuul. Het komt voort uit de ongelijke verdeling van elektronen in een covalente binding.
Belangrijke factoren die dipoolmoment bepalen:
1. Polaire bindingen: Een polaire binding vormt wanneer twee atomen met verschillende elektronegativiteit elektronen delen. Het meer elektronegatief atoom trekt de gedeelde elektronen dichterbij, waardoor een gedeeltelijke negatieve lading (δ-) ontstaat op dat atoom en een gedeeltelijke positieve lading (δ+) op het minder elektronegatieve atoom.
2. Moleculaire geometrie: Zelfs als een molecuul polaire bindingen heeft, heeft het mogelijk geen netto dipoolmoment. Dit komt omdat de dipoolmomenten van individuele bindingen elkaar kunnen annuleren als het molecuul een symmetrische geometrie heeft.
Voorbeelden van moleculen met dipoolmomenten:
* water (h₂o): Het zuurstofatoom is meer elektronegatief dan de waterstofatomen, waardoor polaire bindingen ontstaan. De gebogen geometrie van water betekent dat de dipoolmomenten van de twee O-H-obligaties niet worden geannuleerd, wat resulteert in een netto dipoolmoment.
* waterstofchloride (HCl): Chloor is elektronegatiefer dan waterstof, waardoor een polaire binding en een dipoolmoment ontstaat.
* ammoniak (NH₃): Het stikstofatoom is elektronegatiefer dan de waterstofatomen, waardoor polaire bindingen ontstaan. De trigonale piramidale geometrie van ammoniak betekent dat de dipoolmomenten van de N-H-obligaties niet worden geannuleerd, wat leidt tot een netto dipoolmoment.
Voorbeelden van moleculen zonder dipoolmomenten:
* koolstofdioxide (co₂): De koolstofoxygenbindingen zijn polair, maar de lineaire geometrie van het molecuul betekent dat de dipoolmomenten worden geannuleerd.
* methaan (ch₄): De koolstofhydrogen-bindingen zijn enigszins polair, maar de tetraëdrische geometrie resulteert in de dipoolmomenten die worden geannuleerd.
Samenvattend:
* Een dipoolmoment bestaat in een molecuul als er een ongelijke verdeling van elektronendichtheid is, wat leidt tot een scheiding van lading.
* Polaire bindingen zijn noodzakelijk, maar de moleculaire geometrie speelt een cruciale rol bij het bepalen of de dipoolmomenten van individuele bindingen annuleren.
 VS plant 1 miljard bomen omdat bossen door klimaatverandering verdwijnen
VS plant 1 miljard bomen omdat bossen door klimaatverandering verdwijnen Waarom moet je de tuin schoon houden?
Waarom moet je de tuin schoon houden?  Wetenschappers vinden hoogste gehalte aan microplastics ooit op zeebodem
Wetenschappers vinden hoogste gehalte aan microplastics ooit op zeebodem Enorme voorraden Arctisch zee-ijs hebben waarschijnlijk bijgedragen aan de afkoeling van het klimaat in het verleden
Enorme voorraden Arctisch zee-ijs hebben waarschijnlijk bijgedragen aan de afkoeling van het klimaat in het verleden Nieuwe wegen in onderwijs over klimaatverandering:drama als sleutel tot verandering?
Nieuwe wegen in onderwijs over klimaatverandering:drama als sleutel tot verandering?
Hoofdlijnen
- Hoe een ontevreden wetenschapper wilde bewijzen dat zijn voedsel niet nieuw ontdekte radioactieve tracers was en de Nobelprijs won
- Wetenschappers laten zien hoe bacterieel 'aanvalshond'-toxine de eiwitsynthese verstoort
- Nieuwe inzichten in hoe het HIV-1 envelopeiwit assembleert en opneemt
- Hoe wordt het ene geslacht groter dan het andere?
- Maleisië omarmt het werk van Melanies aan de illegale handel in wilde dieren
- Bal of knuffel:'weten' honden wat ze ruiken?
- Waarom gifkikkers zichzelf niet vergiftigen?
- Kunnen schimmels plastic vervangen?
- Een gedenatureerd eiwit kan zich opnieuw vormen naar zijn functionele vorm wanneer het in de normale omgeving wordt teruggebracht. Wat betekent dat voor een bevestiging?
- Nieuwe studie verklaart Mycobacterium tuberculosis hoge weerstand tegen medicijnen en immuniteit
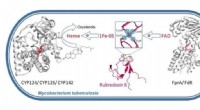
- Nieuwe methode voor het opsporen van ziekten, waaronder coronavirus en cystische fibrose

- Firefly-gen verlicht het vermogen van geoptimaliseerd CRISPR-Cpf1 om het menselijk genoom efficiënt te bewerken

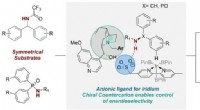
- Door metaal gekatalyseerde reacties die enantioselectief zijn gemaakt met behulp van chiraal kation
- Simulatie op atoomschaal van antiaritmische geneesmiddelinteractie met hartcellen

 Welk weer zouden we op het land hebben als de wind wolken naar zee blaast?
Welk weer zouden we op het land hebben als de wind wolken naar zee blaast?  Nieuw medicijnafgiftesysteem geeft alleen therapeutische lading vrij als er bacteriën aanwezig zijn
Nieuw medicijnafgiftesysteem geeft alleen therapeutische lading vrij als er bacteriën aanwezig zijn De werkelijke kosten van seksuele intimidatie op het werk voor bedrijven
De werkelijke kosten van seksuele intimidatie op het werk voor bedrijven Hoe vindt een kolibrie voedsel?
Hoe vindt een kolibrie voedsel?  Atomair dun materiaal opent deur voor geïntegreerde nanofotonische circuits
Atomair dun materiaal opent deur voor geïntegreerde nanofotonische circuits Hoe luid zijn baking soda-bommen?
Hoe luid zijn baking soda-bommen?  Wat is de evenwichtige vergelijking voor magnesiumchloride plus zwavelzuur?
Wat is de evenwichtige vergelijking voor magnesiumchloride plus zwavelzuur?  Elektronen lijken zwaarder in extreem dun silicium
Elektronen lijken zwaarder in extreem dun silicium
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

