
Wetenschap
Hoe heeft Bohr het Rutherford -model van Atom veranderd?
Model van Rutherford:
* voorgesteld: Het model van Ernest Rutherford, gebaseerd op zijn goudfolie -experiment, beschreef het atoom als een positief geladen kern omringd door negatief geladen elektronen die het rond de zon ronddraaien.
* Beperkingen: Het model van Rutherford kon niet uitleggen:
* Waarom atomen specifieke golflengten van licht uitzenden (spectrale lijnen)
* Waarom elektronen niet in de kern spiraalden vanwege elektromagnetisch stralingsverlies
Bohr's verbeteringen:
1. Gekwantiseerde energieniveaus: Bohr stelde voor dat elektronen alleen specifieke energieniveaus konden bezetten, banen rond de kern konden worden genoemd. Deze energieniveaus werden gekwantiseerd, wat betekent dat ze alleen konden bestaan op discrete waarden. Hij vergeleek deze banen met de sporten van een ladder, waar elektronen van de ene sport naar de andere konden springen.
2. Elektronenovergangen: Bohr legde uit dat wanneer een elektron overstapte van een hoger energieniveau naar een lager, het een foton van licht uitgezonden met energie gelijk aan het verschil in energie tussen de twee niveaus. Dit verklaarde de waargenomen spectrale lijnen, waarbij elke lijn overeenkomt met een specifieke energietransitie.
3. Angular Momentum kwantisatie: Bohr stelde verder voor dat het hoekmomentum van een elektron in een baan werd gekwantiseerd. Dit betekende dat het hoekmomentum van het elektron alleen specifieke discrete waarden kon aannemen.
Impact van het model van Bohr:
* uitgelegd atomaire spectra: Het model van Bohr legde met succes de waargenomen spectrale lijnen van waterstofatomen uit, een belangrijke triomf die sterk bewijs leverde voor de kwantisatie van energieniveaus in atomen.
* Foundation voor kwantummechanica: Het model van Bohr legde de basis voor de ontwikkeling van de kwantummechanica, die een revolutie teweegbracht in ons begrip van het atoom en de aard van het licht.
* Beperkingen: Hoewel een belangrijke stap voorwaarts, was het model van Bohr beperkt in zijn reikwijdte en kon de spectra van complexere atomen niet volledig verklaren. Het ontbrak ook een volledige verklaring voor hoe de overgang van elektronen tussen energieniveaus.
Samenvattend: Het model van Bohr was een aanzienlijke verbetering ten opzichte van het model van Rutherford en introduceerde de concepten van gekwantiseerde energieniveaus en elektronenovergangen. Hoewel het zijn beperkingen had, markeerde het een keerpunt in ons begrip van de atomaire structuur en maakte het de weg vrij voor de ontwikkeling van meer geavanceerde kwantummodellen.
 Verbetering van klimaatobservaties biedt een groot investeringsrendement
Verbetering van klimaatobservaties biedt een groot investeringsrendement Het smeltwater van de Groenlandse ijskap kan in de winter stromen, te
Het smeltwater van de Groenlandse ijskap kan in de winter stromen, te Lijst met buideldieren
Lijst met buideldieren Opwarming van de aarde van 1,5C of 2C:de ondergrens zou het overstromingsgevaar verminderen
Opwarming van de aarde van 1,5C of 2C:de ondergrens zou het overstromingsgevaar verminderen GPM ziet tyfoon Talim de eilanden van Japan bedreigen
GPM ziet tyfoon Talim de eilanden van Japan bedreigen
Hoofdlijnen
- Onderzoek dat aantoont waarom hiërarchie bestaat, zal de ontwikkeling van kunstmatige intelligentie bevorderen
- Wat zijn de functies van cellenmembraan?
- Afrikaanse slaapziekte:hoe de ziekteverwekker tseetseevliegen koloniseert
- Nieuw onderzoek wijst uit waarom sommige microbiële genen meer promiscue zijn dan andere
- Welke tak van wetenschapsiabetes hoort erbij?
- Wetenschappers controleren cellen met licht,
- Is ze zwanger? DC Zoo zegt dat de hormonen van panda stijgen
- Dynamische beelden tonen ruitvormige protease in actie
- In Brazilië hoopt men AI te kunnen gebruiken om dieren in het wild te behoeden voor verkeersdoden
- Ontdekking van levensverlengingspad in wormen toont nieuwe manier om veroudering te bestuderen
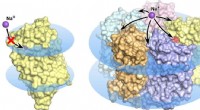
- Biofysici lossen de ware structuur van het veelbelovende optogenetische eiwit KR2 rhodopsine op
- Onderzoekers ontwikkelen zeer nauwkeurige sensor voor detectie van E. coli-risico's
- Fotokathoden van koperoxide:laserexperiment onthult locatie van efficiëntieverlies

- Goedkope waterbehandeling

 Georganiseerde cybercriminaliteit - geen doorsnee maffia
Georganiseerde cybercriminaliteit - geen doorsnee maffia De eerste eukaryotische organismen op aarde waren?
De eerste eukaryotische organismen op aarde waren?  Uit onderzoek blijkt hoe duikende zoogdieren het uithoudingsvermogen onder water ontwikkelden
Uit onderzoek blijkt hoe duikende zoogdieren het uithoudingsvermogen onder water ontwikkelden  Vermont verlaagt prikkels voor programma voor hernieuwbare energie
Vermont verlaagt prikkels voor programma voor hernieuwbare energie Moderne economische theorie verklaart prehistorische mediterrane samenlevingen
Moderne economische theorie verklaart prehistorische mediterrane samenlevingen Onderzoekers ontdekken hoe water wordt geregenereerd op asteroïden
Onderzoekers ontdekken hoe water wordt geregenereerd op asteroïden Hoe wordt breking gebruikt bij het vissen?
Hoe wordt breking gebruikt bij het vissen?  NASA selecteert nieuwe missie om de oorsprong van het universum te verkennen
NASA selecteert nieuwe missie om de oorsprong van het universum te verkennen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

