
Wetenschap
Welke informatie in een evenwichtige chemische vergelijking laat zien hoeveel mol reactant de reactie betreft?
Hier is hoe het werkt:
* coëfficiënten: Dit zijn de getallen geschreven voor elke chemische formule in de vergelijking.
* mol: De coëfficiënten vertegenwoordigen het relatieve aantal mol mol van elke reactant en product dat bij de reactie betrokken is.
Voorbeeld:
De evenwichtige chemische vergelijking voor de verbranding van methaan is:
`` `
CH4 + 2O2 → CO2 + 2H2O
`` `
Deze vergelijking vertelt ons:
* 1 mol van methaan (CH4) reageert met 2 mol van zuurstof (O2).
* Dit produceert 1 mol van koolstofdioxide (CO2) en 2 mol van water (H2O).
Key Takeaway: De stoichiometrische coëfficiënten in een gebalanceerde chemische vergelijking bieden de molverhoudingen tussen reactanten en producten, waardoor we het exacte aantal mol kunnen bepalen dat bij de reactie betrokken is.
 Onderzoekers realiseren een ethyleenmethoxycarbonyleringsreactie via een katalysator met één atoom
Onderzoekers realiseren een ethyleenmethoxycarbonyleringsreactie via een katalysator met één atoom  Milligram per milliliter berekenen
Milligram per milliliter berekenen Chemici kristalliseren nieuwe benadering van materiaalwetenschap uit
Chemici kristalliseren nieuwe benadering van materiaalwetenschap uit De meeste ionische verbindingen bestaan uit een?
De meeste ionische verbindingen bestaan uit een?  Wetenschappers melden een nieuwe cascadereactie
Wetenschappers melden een nieuwe cascadereactie
 Rotsvochtigheid in de Spaanse dehesas:een extra bron van water voor vegetatie
Rotsvochtigheid in de Spaanse dehesas:een extra bron van water voor vegetatie Hoe heet het proces waarbij bomen koolstofdioxide uit de atmosfeer opnemen en zuurstof weer vrijgeven?
Hoe heet het proces waarbij bomen koolstofdioxide uit de atmosfeer opnemen en zuurstof weer vrijgeven?  Hoe gletsjers werken
Hoe gletsjers werken  Klimaatverandering zorgt ervoor dat herfstbladeren eerder van kleur veranderen - dit is waarom
Klimaatverandering zorgt ervoor dat herfstbladeren eerder van kleur veranderen - dit is waarom Egg Parachute Design Instructions
Egg Parachute Design Instructions
Hoofdlijnen
- Kan zeewier gasachtige koeien op melkveebedrijven verlichten?
- Wat zijn de enkelvoudige zelfstandige naamwoorden van schimmels?
- Uit onderzoek blijkt hoe bodembacteriën klaar zijn om broeikasgassen te consumeren
- Onderzoek levert inzicht op in hoe plantencellen groeien
- Is Plantae enkelvoudig cellen of meercellulair?
- Cheerleaders helpen bij het ontdekken van bacteriën die beter groeien zonder zwaartekracht
- Wanneer kan het fenotype je genotype van een eigenschap vertellen?
- Wat is de wetenschappelijke naam voor Diplococcus Pheumoniae?
- Wat is een specialisatie van zenuwcel?
- Een 3D-beeldvormingstechniek ontgrendelt eigenschappen van perovskietkristallen
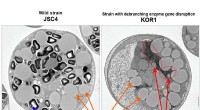
- Koolhydraten omzetten in lipiden voor biobrandstoffen voor microalgen
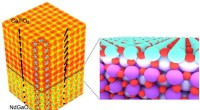
- Zeer efficiënte maliënkolderkatalysatoren ontwikkeld voor ontkoppelde waterelektrolyse
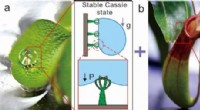
- Een nieuw salvinia-achtig glad oppervlak
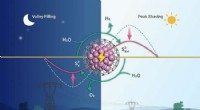
- Nobelprijs voor baanbrekende manier om moleculen te bouwen die chemie groener maakten

 IJsverlies zal waarschijnlijk doorgaan op Antarctica
IJsverlies zal waarschijnlijk doorgaan op Antarctica Groot ruimtemysterie opgelost met gegevens van studentensatelliet
Groot ruimtemysterie opgelost met gegevens van studentensatelliet Onderzoekers observeren warmte-uitwisseling in een exotisch materiaal
Onderzoekers observeren warmte-uitwisseling in een exotisch materiaal Waarom verandert het pad van licht wanneer het een ander medium binnenkomt?
Waarom verandert het pad van licht wanneer het een ander medium binnenkomt?  Kan deze man Intel helpen de AI-golf te vangen?
Kan deze man Intel helpen de AI-golf te vangen?  De betekenis van de Death Tarot-kaart ontdekken
De betekenis van de Death Tarot-kaart ontdekken  Afbeelding:Hubbles prachtig uitzicht op een stellaire kinderkamer
Afbeelding:Hubbles prachtig uitzicht op een stellaire kinderkamer 'Hoe weten we wat we niet weten?':Wetenschappers definiëren het proces van methylering volledig
'Hoe weten we wat we niet weten?':Wetenschappers definiëren het proces van methylering volledig
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

