
Wetenschap
Wat gebeurt er met ionen nadat zout water verdampt?
1. De basisprincipes van zout water
* zout (NaCl): Zout lost op in water en breekt af in zijn componentionen:positief geladen natriumionen (Na+) en negatief geladen chloride-ionen (Cl-).
* Water (H2O): Watermoleculen zijn polair, wat betekent dat ze een enigszins positief uiteinde en een enigszins negatief uiteinde hebben. Deze polariteit stelt hen in staat om de ionen aan te trekken en te omringen, waardoor ze opgelost blijven.
2. Verdamping
* Watermoleculen ontsnappen: Wanneer water verdampt, krijgen de watermoleculen voldoende energie om los te breken van de vloeibare toestand en waterdamp in de lucht te worden.
* ionen achtergelaten: Omdat de ionen (Na+ en Cl-) veel zwaarder zijn en sterkere aantrekkingskracht op elkaar hebben dan voor de watermoleculen, hebben ze niet genoeg energie om te ontsnappen met de waterdamp.
3. Het resultaat:zoutkristallisatie
* concentratie neemt toe: Naarmate water verdampt, neemt de concentratie ionen in het resterende water toe.
* Crystal Formation: Uiteindelijk wordt de concentratie van ionen zo hoog dat de aantrekkelijke krachten tussen hen de krachten overwinnen die hen in oplossing houden. De ionen beginnen samen te komen en vormen een gewone, herhaalde structuur - een zoutkristal.
Samenvattend: Wanneer zoutwater verdampt, ontsnappen de watermoleculen als damp, waardoor de opgeloste ionen achterblijven. Deze ionen soorten vervolgens weer in elkaar om vaste zoutkristallen te vormen.
 Waarom zijn kationen kleiner dan ouderionen?
Waarom zijn kationen kleiner dan ouderionen?  Distillatie is een proces dat twee vloeistoffen kan scheiden met behulp van wat?
Distillatie is een proces dat twee vloeistoffen kan scheiden met behulp van wat?  Hoe het aantal atomen in een element te vinden
Hoe het aantal atomen in een element te vinden Hoe groot is te groot? Amazon wekt zorgen over de antitrustwetgeving
Hoe groot is te groot? Amazon wekt zorgen over de antitrustwetgeving  Wat zijn de 3 soorten verbindingen en hun voorbeelden in de chemie?
Wat zijn de 3 soorten verbindingen en hun voorbeelden in de chemie?
 Orkaan Douglas raast over Hawaï terwijl pandemie oplaait
Orkaan Douglas raast over Hawaï terwijl pandemie oplaait Een regenbuigenerator beoordeelt de regenval in het stroomgebied onder simulaties van klimaatverandering
Een regenbuigenerator beoordeelt de regenval in het stroomgebied onder simulaties van klimaatverandering Softwaretool kan laten zien wanneer de afvalwaterzuivering van een stad faalt
Softwaretool kan laten zien wanneer de afvalwaterzuivering van een stad faalt Stop de houtkap na verstoring in bossen
Stop de houtkap na verstoring in bossen Robotonderzeeër maakt allereerste foto's bij fundering van beruchte Antarctische gletsjer
Robotonderzeeër maakt allereerste foto's bij fundering van beruchte Antarctische gletsjer
Hoofdlijnen
- Vrouwelijke wetenschappers die de wereld veranderden
- Welk celdeel in een amoebe wordt waarschijnlijk gebruikt om de uitbreiding te maken?
- Kwallen op het menu
- Wat is een woord voor bacteriën?
- Nieuwe zoomtechniek onthult voor het eerst een elektrisch circuit van cellen
- Hoe kunnen de structuren van een plantencel als deels voedselketen functioneren?
- Ondanks bosverlies, een beschermd Afrikaans gebied heeft nog steeds potentieel om tienduizenden olifanten te ondersteunen, 1K leeuwen
- Welk type sporen produceert Selanginella?
- Wat zijn de drie componenten van een DNA-molecuul?
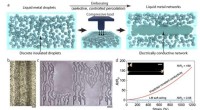
- Zelfherstellende elastomeren van vloeibaar metaal
- In het glas kijken

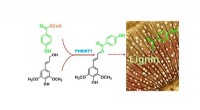
- Wetenschappers ID-enzym voor het maken van belangrijke industriële chemicaliën in planten
- Chemiluminescentiesondes voor de snelle en gevoelige detectie van salmonella en listeria
- Wetenschappers ontwikkelen efficiënte methode om zeer sterke materialen te maken voor flexibele elektronica

 Vluchtende nazi's hebben generaties lang na de Tweede Wereldoorlog de Oostenrijkse politiek gevormd:studie
Vluchtende nazi's hebben generaties lang na de Tweede Wereldoorlog de Oostenrijkse politiek gevormd:studie Opinie:jonge Amerikanen verdienen een 21e-eeuwse maanopname naar Mars
Opinie:jonge Amerikanen verdienen een 21e-eeuwse maanopname naar Mars Schonere lucht als gevolg van pandemische lockdown
Schonere lucht als gevolg van pandemische lockdown Babysteps voor transparante elektronica
Babysteps voor transparante elektronica China Air Pollution Data Center gelanceerd om de zich ontwikkelende complexiteit van uitdagingen op het gebied van de luchtkwaliteit te bestrijden
China Air Pollution Data Center gelanceerd om de zich ontwikkelende complexiteit van uitdagingen op het gebied van de luchtkwaliteit te bestrijden  Hoeveel ijs zal 1 gallon water maken?
Hoeveel ijs zal 1 gallon water maken?  Hoeveel elektriciteit vereist thuis entertainmentsystemen?
Hoeveel elektriciteit vereist thuis entertainmentsystemen?  Welke hoofdfactoren beïnvloeden de vegetatie?
Welke hoofdfactoren beïnvloeden de vegetatie?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

