
Wetenschap
170 ml van een koper II -acetaatoplossing van 0,30 m wordt gemengd met een overtollig natriumsulfide Hoeveel gram zal zich vormen?
1. Schrijf de gebalanceerde chemische vergelijking
De reactie tussen koper (II) acetaat (Cu (ch₃coo) ₂) en natriumsulfide (NA₂S) produceert koper (II) sulfide (CUS) neerslag en natriumacetaat (nach₃coo) in oplossing.
De evenwichtige vergelijking is:
Cu (ch₃coo) ₂ (aq) + na₂s (aq) → cus (s) + 2 nach₃coo (aq)
2. Bereken mol koper (II) acetaat
* molariteit =mol opgeloste stof / liters van oplossing
* We hebben 170 ml (0,170 L) van 0,30 M koper (II) acetaat.
* De formule herschikken: mol opgeloste stof =molariteit * liters oplossing
* mol Cu (ch₃coo) ₂ =0,30 m * 0,170 l =0,051 mol
3. Bepaal beperkende reactant
* Omdat natriumsulfide overtollig is, is koper (II) acetaat de beperkende reactant. Dit betekent dat de hoeveelheid gevormde neerslag wordt bepaald door de hoeveelheid koper (II) acetaat die beschikbaar is.
4. Bereken mol koper (II) sulfide neerslag
* De gebalanceerde vergelijking toont een 1:1 molverhouding tussen Cu (ch₃coo) ₂ en CUS.
* Daarom zal 0,051 mol Cu (ch₃coo) ₂ 0,051 mol CU's produceren.
5. Bereken de massa koper (II) sulfide neerslag
* mols =massa / molaire massa
* De molaire massa CUS is 95,61 g/mol.
* De formule herschikken: massa =mol * molaire massa
* Massa van CUS =0,051 mol * 95,61 g/mol =4,88 gram
Daarom zal ongeveer 4,88 gram koper (II) sulfide -neerslag vormen.
 Wat is het denkbeeldige paradijs op aarde?
Wat is het denkbeeldige paradijs op aarde?  Nieuw systeem voor vroegtijdige waarschuwing bij bosbranden kan voorjaarsbranden voorkomen
Nieuw systeem voor vroegtijdige waarschuwing bij bosbranden kan voorjaarsbranden voorkomen Technologieën schijnen de schijnwerpers op de klimaatrol van onderzeese canyons
Technologieën schijnen de schijnwerpers op de klimaatrol van onderzeese canyons Broeikasgassen terugdringen en tegelijkertijd de vraag naar vlees in evenwicht brengen
Broeikasgassen terugdringen en tegelijkertijd de vraag naar vlees in evenwicht brengen What Are Shrimps Prey?
What Are Shrimps Prey?
Hoofdlijnen
- Hoe hersendood werkt
- "DNA Model Project Ideas
- Hoeveel takken van BSC -wetenschap zijn er?
- De meeste zeeschildpadden zijn nu vrouwelijk in het noorden van het Great Barrier Reef
- Wat zijn niet -voorbeelden van de celcyclus?
- The Stages of the Human Decomposition Process
- Waar zijn moleculen van voedsel dat betrokken is bij de ATP- en ADP -cyclus?
- Is de houtkap in Victoria echt gestopt? Wat de dood van een met uitsterven bedreigd zweefvliegtuig ons vertelt
- Wat is het bouwproces van lipiden?
- Techniek onthult diepere inzichten in de samenstelling van parelmoer, een natuurlijk materiaal
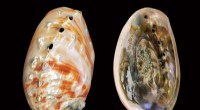
- Wetenschappers ontwikkelen goedkope energie-efficiënte materialen

- Nieuwe modelleringsaanpak helpt bij het ontwerpen van laserglas

- De betekenis van water in een veelbelovende biomarker tegen kanker

- Metamaterialen bieden multifunctionele materialen voor engineering

 Verre 'ruimtesneeuwman' ontsluit mysterie over hoe sommige slapende objecten in de diepe ruimte 'ijsbommen' worden
Verre 'ruimtesneeuwman' ontsluit mysterie over hoe sommige slapende objecten in de diepe ruimte 'ijsbommen' worden  Antimaterie creëren via lasers?
Antimaterie creëren via lasers?  Een nieuwe slimme gevellift voor oudere gebouwen
Een nieuwe slimme gevellift voor oudere gebouwen Wetenschappers ontdekken een proces dat het helderder maken van kwantumstippen in de weg staat
Wetenschappers ontdekken een proces dat het helderder maken van kwantumstippen in de weg staat Welke gassen houden warmte vast in de atmosfeer?
Welke gassen houden warmte vast in de atmosfeer?  Tasmanië herbergt bedreigde oude culturele landschappen
Tasmanië herbergt bedreigde oude culturele landschappen Wat is een pH-waarde van 9?
Wat is een pH-waarde van 9?  Diamantachtige koolstof wordt anders gevormd dan werd aangenomen - machine learning maakt de ontwikkeling van een nieuw model mogelijk
Diamantachtige koolstof wordt anders gevormd dan werd aangenomen - machine learning maakt de ontwikkeling van een nieuw model mogelijk
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

