
Wetenschap
Hoe berekent u de activeringsenergie bij katalyse?
1. Arrhenius -vergelijking:
Dit is de meest voorkomende methode en omvat het bestuderen van reactiesnelheden bij verschillende temperaturen. De Arrhenius -vergelijking is:
k =a * exp (-ea/rt)
Waar:
* K is de snelheidsconstante van de reactie
* a is de pre-exponentiële factor (frequentiefactor)
* ea is de activeringsenergie
* r is the ideal gas constant (8.314 J/mol·K)
* t is de absolute temperatuur in Kelvin
Om EA te berekenen met behulp van de Arrhenius -vergelijking, moet u:
* Meet de snelheidsconstante (K) bij twee of meer verschillende temperaturen.
* plot ln (k) versus 1/t. Dit geeft je een rechte lijn met een helling van -Ea/r.
* Bereken de helling van de lijn en vermenigvuldig deze met -r om ea te verkrijgen.
2. Eyring -vergelijking (overgangstoestandstheorie):
Deze methode is complexer, maar kan een nauwkeuriger waarde bieden voor EA. Het relateert de snelheidsconstante aan de Gibbs -vrije activeringsenergie (ΔG ‡):
k =(k_B * T / h) * exp(-ΔG‡/RT)
Waar:
* k_B is de Boltzmann constant
* h is de planck constant
* ΔG ‡ is de Gibbs -vrije activeringsenergie
om EA te berekenen met behulp van de Eyring -vergelijking:
* Bepaal de Gibbs -vrije activeringsenergie (ΔG ‡) met behulp van experimentele gegevens.
* Gebruik de vergelijking ΔG ‡ =ΔH ‡ - Tδs ‡ om de enthalpie van activering te berekenen (ΔH ‡).
* ea =ΔH ‡ + rt.
3. Computationele methoden:
Geavanceerde computationele chemische methoden kunnen worden gebruikt om de activeringsenergie te berekenen, vooral voor complexe reacties. Deze methoden omvatten:
* Kwantummechanische berekeningen: Deze methoden bieden zeer nauwkeurige waarden voor EA.
* moleculaire dynamieksimulaties: Deze methoden simuleren de beweging van atomen en moleculen, zodat u informatie kunt verkrijgen over de reactieroute en de activeringsenergie.
Key Points to Remember:
* Katalysatoren verlagen de activeringsenergie van een reactie, maar ze veranderen de evenwichtsconstante niet. Dit betekent dat ze de reactiesnelheid versnellen, maar geen invloed hebben op de uiteindelijke hoeveelheden reactanten en producten in evenwicht.
* Activeringsenergiewaarden worden typisch tot expressie gebracht in eenheden van joules per mol (J/mol) of kilojoule per mol (kj/mol).
De juiste methode kiezen:
The choice of method depends on the available experimental data, the complexity of the reaction, and the desired level of accuracy. De ARRHENIUS -vergelijking is geschikt voor eenvoudige reacties met een direct beschikbare snelheidsconstante gegevens. De Eyring -vergelijking is nauwkeuriger, maar vereist aanvullende informatie over de overgangstoestand. Computationele methoden bieden een hoge nauwkeurigheid, maar vereisen gespecialiseerde software en expertise.
 Flavins houden een handige helper in hun zak
Flavins houden een handige helper in hun zak Wat is de uitgebalanceerde vergelijking voor de relatie tussen kalium en water om kaliumhydroxide en koh-waterstof te vormen?
Wat is de uitgebalanceerde vergelijking voor de relatie tussen kalium en water om kaliumhydroxide en koh-waterstof te vormen?  Hoe wordt de temperatuur gebruikt om een faseverandering te herkennen?
Hoe wordt de temperatuur gebruikt om een faseverandering te herkennen?  Is Mercurius een gas of rots?
Is Mercurius een gas of rots?  Kan ik deze chemicaliën mengen? Daar is een app voor!
Kan ik deze chemicaliën mengen? Daar is een app voor!
 Metaalafzettingen van Chinese kolencentrales komen terecht in de Stille Oceaan, uit onderzoek blijkt
Metaalafzettingen van Chinese kolencentrales komen terecht in de Stille Oceaan, uit onderzoek blijkt Een (veel) eerdere geboortedatum voor tektonische platen
Een (veel) eerdere geboortedatum voor tektonische platen Om groene steden mainstream te maken, we moeten leren van lokale succesverhalen en opschalen
Om groene steden mainstream te maken, we moeten leren van lokale succesverhalen en opschalen Verhoogde luchtvervuiling kan de gezondheidsvoordelen van het leven in beloopbare gemeenschappen verminderen
Verhoogde luchtvervuiling kan de gezondheidsvoordelen van het leven in beloopbare gemeenschappen verminderen Studie biedt eerste holistische beoordeling van plasticvervuiling in het Caribisch gebied
Studie biedt eerste holistische beoordeling van plasticvervuiling in het Caribisch gebied
Hoofdlijnen
- Waar komt de kleur vandaan in paarse kool?
- Wat is een goede uitleg van instantiaat?
- Wat hebben andere dieren dat haar?
- Hoe de gecorrigeerde WBC-telling te berekenen
- Wat is een wetenschapper die alles bestudeert?
- Algoritme legt uit hoe mieren padennetwerken maken en repareren
- Wat zijn de zes menselijke levensprocessen?
- Experimentele evolutie laat zien hoe bacteriën resistentie tegen geneesmiddelen verkrijgen
- Wie heeft echt DNA ontdekt?
- Decennia lang onderzoek mondt uit in een nieuwe manier om links- en rechtshandige moleculen te maken

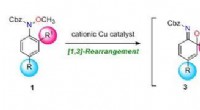
- Efficiënte synthese van meervoudig gesubstitueerde anilinen door domino-omlegging
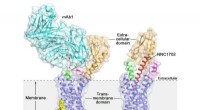
- Glucagon-receptorstructuur biedt nieuwe mogelijkheden voor het ontdekken van geneesmiddelen voor type 2 diabetes
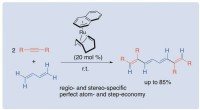
- Een efficiënte benadering van geconjugeerde tetraenen uit butadieen en alkynen
- De inkt van de toekomst in gedrukte elektronica

 Hoe beïnvloedt de temperatuur de reactiesnelheid?
Hoe beïnvloedt de temperatuur de reactiesnelheid?  Blauwe pigmentontdekker maakt belangrijke ontwerpvooruitgang voor toekomstig duurzaam, levendige pigmenten
Blauwe pigmentontdekker maakt belangrijke ontwerpvooruitgang voor toekomstig duurzaam, levendige pigmenten Hoe zwarte gaten sterrenstelsels vormen
Hoe zwarte gaten sterrenstelsels vormen Aboriginal dakloosheid vereist een andere culturele benadering
Aboriginal dakloosheid vereist een andere culturele benadering Koolstofbelastingen kunnen zowel eerlijk als effectief zijn, studie toont
Koolstofbelastingen kunnen zowel eerlijk als effectief zijn, studie toont Wetenschappers ontdekken hoe ze warmte op hun plaats kunnen 'vasthouden' met behulp van de kwantummechanica
Wetenschappers ontdekken hoe ze warmte op hun plaats kunnen 'vasthouden' met behulp van de kwantummechanica  Otto Fritz Meyerhof
Otto Fritz Meyerhof  Hoe een decimaal te schrijven uit de gearceerde grafiek
Hoe een decimaal te schrijven uit de gearceerde grafiek
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

