Wetenschap
Glucagon-receptorstructuur biedt nieuwe mogelijkheden voor het ontdekken van geneesmiddelen voor type 2 diabetes
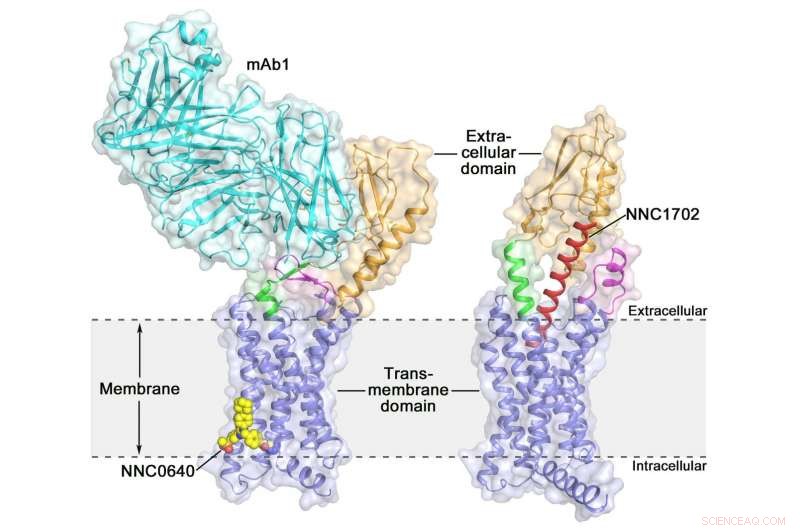
De kristalstructuur van de menselijke glucagonreceptor over de volledige lengte (GCGR) kristalstructuur van de menselijke glucagonreceptor over de volledige lengte (GCGR):oranje (extracellulair domein), blauw (transmembraandomein), groen (stengel), magenta (de eerste extracellulaire lus), rood (NNC1702), geel (NNC0640) en cyaan (mAb1) Credit:Dr. WU Beili
Klasse B G-eiwit-gekoppelde receptoren (GPCR's) oefenen een essentiële werking uit bij hormonale homeostase en zijn belangrijke therapeutische doelen voor een verscheidenheid aan ziekten, waaronder metabole stoornissen zoals type 2 diabetes. Deze receptoren bestaan uit een extracellulair domein (ECD) en een transmembraandomein (TMD), die beide nodig zijn om te interageren met hun verwante peptideliganden en om stroomafwaartse signaaltransductie te reguleren. Vanwege problemen bij de hoogwaardige eiwitbereiding, bepaling van de structuur van klasse B GPCR's van volledige lengte blijft een uitdaging, waardoor het begrip van moleculaire mechanismen van receptorwerking wordt beperkt.
Activering van de menselijke glucagonreceptor (GCGR) door zijn endogene ligand glucagon veroorzaakt de afgifte van glucose uit de lever tijdens vasten, waardoor het een potentieel medicijndoelwit is voor diabetes type 2. Vorig jaar, een groep wetenschappers van het Shanghai Institute of Materia Medica (SIMM) van de Chinese Academie van Wetenschappen bepaalde de kristalstructuur van de volledige GCGR gebonden aan een negatieve allosterische modulator NNC0640 en een remmend antilichaam mAb1, daarmee voor het eerst een duidelijk beeld van een full-length klasse B GPCR met hoge resolutie.
Onlangs, wetenschappers van SIMM bepaalden de kristalstructuur van GCGR in complex met een glucagon-analoog en gedeeltelijke agonist NNC1702. Deze structuur onthult, Voor de eerste keer, de moleculaire details van een klasse B GPCR-binding aan zijn peptide-ligand met hoge resolutie en onthult onverwacht de structurele complexiteit die receptoractivering regelt, waardoor het begrip van klasse B GPCR-signaaltransductie aanzienlijk wordt uitgebreid. De studie is gepubliceerd in Natuur .
Deze studie biedt enkele waardevolle inzichten in het activeringsmechanisme van GCGR. De meest opwindende bevinding is dat het linkergebied dat de ECD en TMD van de receptor verbindt, genaamd de "steel, " en de eerste extracellulaire lus ondergaan significante conformationele veranderingen in hun secundaire structuren in de peptide-gebonden GCGR-structuur in vergelijking met de eerder bepaalde niet-peptide-gebonden structuur. Dit leidt tot een duidelijke verandering in de relatieve oriëntatie tussen de ECD en TMD van de receptor om peptidebinding mogelijk te maken en receptoractivering te initiëren.
Verder, de stengel kan receptoractiviteit moduleren door conformationele bewegingen van de receptor TMD te vergemakkelijken. "Het is verbazingwekkend om te zien hoe het stengelgebied zo'n belangrijke rol speelt bij het reguleren van de receptorfunctie, hoewel het slechts 12 aminozuren bevat, "Zei SIMM-professor Dr. ZHAO Qiang. "Dit is nog nooit waargenomen in eerder opgeloste GPCR-structurele studies. Het verdiept de kennis over klasse B GPCR-signaleringsmechanismen aanzienlijk."
Gebaseerd op de structuur van het GCGR-NNC1702-complex, de onderzoekers voerden een reeks functionele studies uit met behulp van technieken zoals competitieve ligandbinding, cel signalering, moleculaire dynamica simulaties en dubbele elektron-elektron resonantie spectroscopie. De resultaten ondersteunen de GCGR-structuur en bevestigen de conformationele veranderingen van de receptor in verschillende functionele toestanden.
"De nieuw opgeloste GCGR-structuur biedt de meest nauwkeurige sjabloon tot nu toe voor het ontwerpen van geneesmiddelen gericht op GCGR, die nieuwe kansen biedt bij het ontdekken van geneesmiddelen voor de behandeling van diabetes type 2, " zei teamleider en SIMM-professor Dr. WU Beili.
 Seismisch onderzoek onthult enorme hoeveelheid water die het binnenste van de aarde is binnengesleept
Seismisch onderzoek onthult enorme hoeveelheid water die het binnenste van de aarde is binnengesleept Vulkanische activiteit en veranderingen in de aardmantel waren de sleutel tot de stijging van zuurstof in de lucht
Vulkanische activiteit en veranderingen in de aardmantel waren de sleutel tot de stijging van zuurstof in de lucht NOAA's grootste schip komt thuis na langste reis
NOAA's grootste schip komt thuis na langste reis NASA vangt tropische cycloon Pola in de buurt van Fiji
NASA vangt tropische cycloon Pola in de buurt van Fiji Gedragsaanpassingen van de kistschildpad
Gedragsaanpassingen van de kistschildpad
Hoofdlijnen
- De structuur van een eukaryote cel
- Onderzoekers creëren nieuwe letters om DNA-functies te verbeteren
- Klimaatverandering die de migratiepatronen van gierende kraanvogels beïnvloedt, studie vondsten
- Aminozuren: functie, structuur, typen
- Onderzoekers richten zich op invasieve, verderfelijke gevlekte lantaarnvlieg
- Belangrijke soorten bacteriën
- Pesticiden en slechte voeding schaden de diergezondheid
- Wat betekent inoculeren in de microbiologie?
- Babyneushoorn galoppeert naar publiek in Singapore Zoo
 Onderzoek identificeert regelmatig klimgedrag bij een menselijke voorouder
Onderzoek identificeert regelmatig klimgedrag bij een menselijke voorouder De computationele methoden van onderzoekers maken de weg vrij voor de volgende generatie membraantechnologie voor waterzuivering
De computationele methoden van onderzoekers maken de weg vrij voor de volgende generatie membraantechnologie voor waterzuivering Hoe fulleriet harder wordt dan diamant
Hoe fulleriet harder wordt dan diamant Hoe Molaire massa van lucht berekenen
Hoe Molaire massa van lucht berekenen  Een patch die tegelijkertijd zes gezondheidsgerelateerde biomarkers meet door zweet te analyseren
Een patch die tegelijkertijd zes gezondheidsgerelateerde biomarkers meet door zweet te analyseren Een superlichtgevende supernova van een massieve voorouderster
Een superlichtgevende supernova van een massieve voorouderster De lijst met nuttige insecten
De lijst met nuttige insecten NYC ClimateClock telt de deadline af naar de Doomsday van het klimaat
NYC ClimateClock telt de deadline af naar de Doomsday van het klimaat
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | Italian |

-
Wetenschap © https://nl.scienceaq.com