
Wetenschap
Waarom is de pH -waarde van zout water 8?
* De bron van het zout: Zeewater heeft bijvoorbeeld meestal een pH van ongeveer 8.1, terwijl zout water gecreëerd door het oplossen van tafelzout (NaCl) in zuiver water een pH dichter bij neutraal zal hebben (ongeveer 7).
* de zoutconcentratie: Hogere zoutconcentraties hebben de neiging de pH enigszins te verhogen.
* De aanwezigheid van andere opgeloste stoffen: Andere ionen en verbindingen in het water kunnen de pH beïnvloeden. Opgelost kooldioxide kan bijvoorbeeld het water zuurder maken, waardoor de pH wordt verlagen.
* Temperatuur: Temperatuur kan de oplosbaarheid van gassen zoals CO2 beïnvloeden, die op zijn beurt de pH beïnvloedt.
Waarom zout water de neiging heeft enigszins alkalisch te zijn:
* Hydrolyse van zout: Terwijl tafelzout (NaCl) zelf neutraal is, wanneer opgelost in water, ondergaat het een lichte hydrolysereactie, waardoor een kleine hoeveelheid hydroxide-ionen (OH-) wordt gevormd, wat leidt tot een enigszins alkalische pH. Dit komt omdat de chloride-ionen (Cl-) uit het zout protonen (H+) van watermoleculen kunnen accepteren, waardoor OH-ionen achterblijven.
Deze lichte alkaliteit wordt echter vaak overschaduwd door andere hierboven genoemde factoren.
Samenvattend is de pH van zoutwater geen vaste waarde. Het kan variëren afhankelijk van de specifieke omstandigheden en samenstelling van het water.
 Een methode om kristallen te construeren met een grote fractie reactieve facetten
Een methode om kristallen te construeren met een grote fractie reactieve facetten Verhoogde bruikbaarheid en precisie bij vasculaire beeldvorming
Verhoogde bruikbaarheid en precisie bij vasculaire beeldvorming Wat is het verschil tussen silicium en germanium volgens de atomaire structuur?
Wat is het verschil tussen silicium en germanium volgens de atomaire structuur?  Een stap op weg naar betere therapieën tegen virussen
Een stap op weg naar betere therapieën tegen virussen Noem ze niet stijf:metalen organische raamwerken vertonen onverwachte flexibiliteit
Noem ze niet stijf:metalen organische raamwerken vertonen onverwachte flexibiliteit
 Wormen die in Sheetrock graven
Wormen die in Sheetrock graven  Toekomst van technologie voor planeetkoeling:studie creëert routekaart voor onderzoek naar geo-engineering
Toekomst van technologie voor planeetkoeling:studie creëert routekaart voor onderzoek naar geo-engineering Een nieuw rapport vat samen hoe klimaatverandering de watercyclus in Duitsland beïnvloedt
Een nieuw rapport vat samen hoe klimaatverandering de watercyclus in Duitsland beïnvloedt Ambrosia-pollen onder controle houden in Detroit:een no-mow-oplossing voor Motown?
Ambrosia-pollen onder controle houden in Detroit:een no-mow-oplossing voor Motown?  Wachten op de volledige breuk
Wachten op de volledige breuk
Hoofdlijnen
- Metagenomische analysesoftware onthult nieuwe oorzaken van het ontstaan van superbacteriën
- 10 fysieke menselijke eigenschappen die door de evolutie achterhaald zijn
- Wat is de studie van hoe genen worden overgedragen van ouders naar hun kinderen en rol bij gezondheidsziekten die bekend staan als?
- Een nieuwe methode voor enzymatische synthese van potentiële RNA-therapieën
- Urban Coopers-haviken overtreffen hun landelijke buren
- Waarom fotosynthese voor sommige planten beter werkt dan voor andere
- Wat is de functie van eierstok?
- Hoe kleine genetische veranderingen bij Yersinia pestis de menselijke geschiedenis veranderden
- Ontbrekende visvangstgegevens? Niet noodzakelijkerwijs een probleem, zegt een nieuwe studie
- Het manipuleren van aardse materialen om de energie van de zon te benutten

- Interactie tussen nanoplastics en pectine, een in water oplosbaar polysacharide
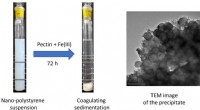
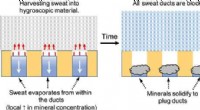
- Het zweet tegen zichzelf keren met een metaalvrije anti-transpirant
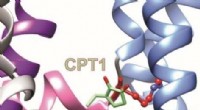
- Onderzoekers ontdekken moleculaire mechanismen van een Afrikaans volksgeneesmiddel
- groener, snellere en goedkopere manier om metalen patronen te maken voor zonnecellen en elektronica

 10 ideeën voor een groene transportinfrastructuur
10 ideeën voor een groene transportinfrastructuur  Hoe bewegen deeltjes in een oppervlaktegolf?
Hoe bewegen deeltjes in een oppervlaktegolf?  Kan een drone de duistere geheimen van de Baai van San Francisco onthullen?
Kan een drone de duistere geheimen van de Baai van San Francisco onthullen?  Is het waar dat halogenen de basis vormen van alle fossiele brandstoffen?
Is het waar dat halogenen de basis vormen van alle fossiele brandstoffen?  NASA ziet de spiraal in tyfoon Cimaron
NASA ziet de spiraal in tyfoon Cimaron Als nieuwe sondes Mars bereiken, dit is wat we tot nu toe weten van reizen naar de rode planeet
Als nieuwe sondes Mars bereiken, dit is wat we tot nu toe weten van reizen naar de rode planeet Ultraverwerkte voedingsmiddelen verwoesten onze gezondheid en de planeet
Ultraverwerkte voedingsmiddelen verwoesten onze gezondheid en de planeet Copernicus-satellieten houden ijsbergen in de gaten voor Vendée Globe
Copernicus-satellieten houden ijsbergen in de gaten voor Vendée Globe
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

