
Wetenschap
Heeft het rode licht van gloeiende neongas slechts één frequentie of een mengsel van frequenties?
* Atomische structuur: Atomen hebben elektronen die kunnen springen tussen energieniveaus. Wanneer een elektron daalt van een hoger naar een lager niveau, geeft het energie vrij in de vorm van licht. Het specifieke energieverschil tussen de niveaus bepaalt de frequentie (en kleur) van het uitgezonden licht.
* NEON'S ENERGIE NIVEAUS: Neon heeft meerdere energieniveaus, wat betekent dat elektronen kunnen overstappen tussen verschillende niveausparen, wat resulteert in verschillende lichtfrequenties.
* dominant rood: Terwijl Neon een spectrum van kleuren uitzendt, bevindt het meest intense en merkbare licht zich in het rode deel van het spectrum, waardoor neontekens hun karakteristieke tint hebben.
Hoewel het rode licht van een neonbord uniform lijkt, bestaat het daarom eigenlijk uit een reeks frequenties, waarbij de rode frequentie het meest prominent is.
 Waarom ozon een uitdaging vormt voor de voedselzekerheid
Waarom ozon een uitdaging vormt voor de voedselzekerheid Optische seismometer overleeft helse top van Caribische vulkaan
Optische seismometer overleeft helse top van Caribische vulkaan Tien jaar na Fukushima, Japanse steden worstelen om gemeenschap weer op te bouwen
Tien jaar na Fukushima, Japanse steden worstelen om gemeenschap weer op te bouwen Regen, overstromingen en groene infrastructuur:verminderen steden de gevaren op billijke wijze?
Regen, overstromingen en groene infrastructuur:verminderen steden de gevaren op billijke wijze? Heeft vegetatie invloed op de hoeveelheid afvoer?
Heeft vegetatie invloed op de hoeveelheid afvoer?
Hoofdlijnen
- De code van mrna is rechtstreeks afhankelijk van de?
- Doen eukaryote cellen door binaire fissie?
- Waar zijn de collaseums van gemaakt?
- Welke hormonen worden gemaakt door de achterste hypofyse?
- Wetenschappers bieden nieuw inzicht in de manier waarop genexpressie wordt gecontroleerd
- Van welke erfenis is de oogkleur bij mensen het resultaat?
- Welk effect heeft klonen op de genenpool?
- Welke feiten beïnvloeden zaadkieming?
- Als de somatische cel 30 chromosomen heeft, hoeveel zitten er dan in de gameten?
- Kunstkraakbeen onder spanning zo sterk als natuurlijk materiaal
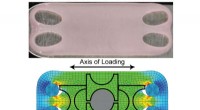
- In vivo geneesmiddelontdekking voor het verhogen van incretine tot expressie brengende cellen bij diabetes

- Vormveranderende receptoren kunnen mysterieuze medicijnmislukkingen verklaren
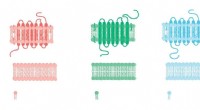
- Wetenschappers houden vast aan spinzijde als biologisch afbreekbaar alternatief voor traditionele lijm

- Kleurgecodeerd - bijpassende smaak met kleur

 Hoe de douane werkt
Hoe de douane werkt  Raciale stereotypen drijven studenten van kleur weg van STEM, maar velen volharden
Raciale stereotypen drijven studenten van kleur weg van STEM, maar velen volharden Kombucha:Wat het is, waar komt het vandaan
Kombucha:Wat het is, waar komt het vandaan  Een regionale push om auto's op te ruimen, vrachtwagens en openbaar vervoer
Een regionale push om auto's op te ruimen, vrachtwagens en openbaar vervoer Mariene wetenschappers bepalen hoe de larven van een veel voorkomende koraalsoort reageren op omgevingsstress
Mariene wetenschappers bepalen hoe de larven van een veel voorkomende koraalsoort reageren op omgevingsstress  Slack is het nieuwste technologiebedrijf dat naar de beurs gaat, met een draai
Slack is het nieuwste technologiebedrijf dat naar de beurs gaat, met een draai Machine learning maakt de weg vrij voor kwantumdetectie op het volgende niveau
Machine learning maakt de weg vrij voor kwantumdetectie op het volgende niveau Hoe veranderen de economische omstandigheden de voorkeuren van consumenten als het gaat om energiebesparing?
Hoe veranderen de economische omstandigheden de voorkeuren van consumenten als het gaat om energiebesparing?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

