
Wetenschap
Vormveranderende receptoren kunnen mysterieuze medicijnmislukkingen verklaren
Krediet:CC0 Publiek Domein
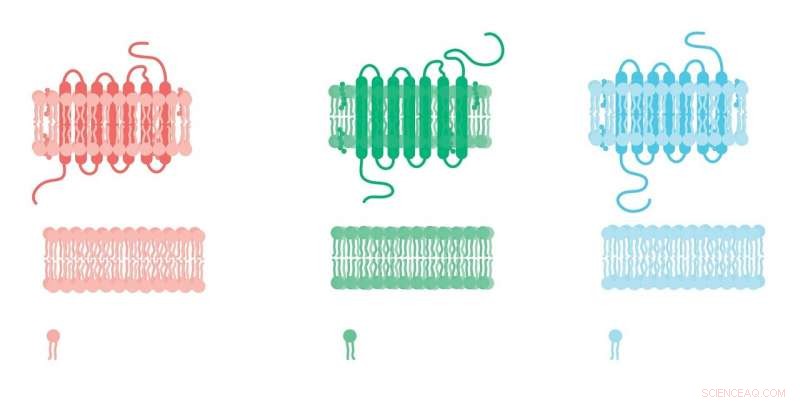
Om suiker zoet te laten smaken en om koffie stimulerend te laten zijn, of zelfs om licht te zien, eerst moeten ze allemaal landen op een aan G-eiwit gekoppelde receptor. Overal en divers, deze receptoren zijn het chemische detectiesysteem van een cel:ze detecteren stoffen in de omgeving en initiëren intracellulaire paden die ten grondslag liggen aan vrijwel alle fysiologische processen - van smaak en zicht tot hormonale regulatie en neuronale communicatie. Bijna een derde van alle therapeutische geneesmiddelen werkt door zich te binden aan deze celoppervlakreceptoren.
Toch was het moeilijk om meer doelwitten voor geneesmiddelen te vinden onder deze groep. en nieuw onderzoek zou kunnen verklaren waarom. Wetenschappers van Rockefeller hebben ontdekt dat veel van deze receptoren, waarvan er bijna 800, interageren met zogenaamde receptoractiviteit-modificerende eiwitten, of RAMP's, waardoor ze andere configuraties in het lichaam aannemen dan in het laboratorium.
De bevinding werd mogelijk gemaakt door een nieuwe techniek die honderden receptoren tegelijk kan onderzoeken om voorheen onbekende RAMP's te onthullen die hun structuur en functie beïnvloeden. Inzichten uit dit onderzoek, beschreven in wetenschappelijke vooruitgang , zou aanzienlijke implicaties kunnen hebben voor de ontdekking van geneesmiddelen en onderzoekers helpen een aantal ziekten te begrijpen.
Een ontbrekend onderdeel
Hoewel uitgebreid bestudeerd, G-eiwit-gekoppelde receptoren blijken nog steeds ongrijpbaar. Veel medicijnen die zich met succes op hen richten in preklinische onderzoeken, falen uiteindelijk in proeven bij mensen. En voor meer dan honderd van deze receptoren, wetenschappers hebben niet eens kunnen identificeren aan welk hormoon of eiwit in het lichaam ze binden.
"Een hypothese is dat er een onderdeel ontbreekt, " zegt Thomas P. Sakmar, de Richard M. en Isabel P. Furlaud Professor en hoofd van Rockefeller's Laboratory of Chemical Biology and Signal Transduction. "Dat onderdeel zou de RAMP kunnen zijn."
RAMP's werden 20 jaar geleden toevallig ontdekt toen een team van onderzoekers werkte aan een G-eiwit gekoppelde receptor, of GPCR, stuitte op een vreemd probleem:dezelfde receptor tot expressie gebracht in twee verschillende cellijnen gebonden aan verschillende verbindingen. Deze variatie, vonden de onderzoekers, werd verklaard door een bijkomend eiwit dat in de ene cellijn aanwezig was en niet in de andere.
Tegenwoordig zijn er drie bekende RAMP's die complexen vormen met GPCR's, wat leidt tot een verandering in de configuratie van de receptor en dus de affiniteit ervan voor een hormoon of geneesmiddel. Uit eerder onderzoek bleek dit waar te zijn voor een handvol GPCR's, maar wetenschappers vermoedden dat als het gaat om RAMP's, ze zagen slechts het topje van de ijsberg.
Bijvoorbeeld, RAMP-mutaties zijn gekoppeld aan verschillende ziekten en het verwijderen ervan bij muizen leidt tot een breed scala aan resultaten. "Verschillende bewijslijnen suggereren dat ze interageren met veel meer GPCR's dan we hebben gewaardeerd, " zegt Emily Lorenzen, een afgestudeerde student in het laboratorium van Sakmar.
Lorenzens eigen studies, gepubliceerd in 2017 en 2019, bevestigde dit vermoeden, dus besloot ze het van dichterbij te bekijken.
De grote zoektocht
Met drie RAMP's en 775 receptoren, het doorzoeken van alle mogelijke combinaties is een ontmoedigende taak. Lorenzen wist dat ze een test moest ontwikkelen om tegelijkertijd een groot aantal eiwitten en hun mogelijke interacties te screenen.
Het idee stuurde haar naar Zweden voor een samenwerking met wetenschappers van het Karolinska Institute, KTH Koninklijk Instituut voor Technologie, en Science for Life-laboratorium. Het team verkreeg antilichamen van het Human Protein Atlas-project die ze koppelden aan magnetische kralen, en vervolgens geïncubeerd met een vloeibaar mengsel van cellen die zijn ontworpen om een combinatie van zowel een RAMP als een receptor te maken.
De kralen zijn voorgekleurd met 500 verschillende kleurstoffen, en de RAMP's kunnen worden gedetecteerd met een seconde, fluorescerend antilichaam. Terwijl de kralen in één enkele rij door een detectie-instrument gaan, hun kleur-ID's worden gelezen en de bijbehorende receptoren en RAMP's worden geïdentificeerd.
In het Science Advances-artikel, het team presenteert hun bevindingen van het testen van de techniek op 23 GPCR's. De resultaten valideerden niet alleen bekende interacties, maar onthulde ook eerder niet-geïdentificeerde RAMP-interacties in extra receptoren.
"Ik zou al blij zijn geweest om zelfs maar een of twee nieuwe interacties te vinden, ' zegt Lorenzen. 'In plaats daarvan hebben we er een stuk of tien.'
Compleet beeld
Geïnspireerd door dit succes, het team past de techniek toe op de rest van de receptoren met als doel hun interacties met alle drie de RAMP's in kaart te brengen, "het hele GPCR-RAMP-interactieoom creëren, ' zegt Sakmar.
Tot dusver, de bevindingen waren consistent:de GPCR-RAMP-interacties zijn veel wijdverspreider dan eerder werd gedacht, een bevinding die belangrijke praktische implicaties heeft. "Bij het bestuderen van GPCR-farmacologie, u moet rekening houden met de status van de RAMP in uw systeem, ", zegt Sakmar. "Het werkelijke doelwit van een medicijn kan het GPCR-RAMP-complex in het celmembraan zijn, niet de receptor op zichzelf."
Dat idee heeft hij al in de praktijk gebracht. Zijn team herevalueert een kleine subfamilie van receptoren die betrokken zijn bij immuunziekten, eerder bestudeerd als belangrijke doelwitten voor geneesmiddelen. "We denken te weten waarom eerdere pogingen om geneesmiddelen te ontdekken niet succesvol waren, " zegt Sakmar. "Er is een RAMP-interactie die niemand heeft gewaardeerd."
Het team hoopt ook het merkwaardige geval van glaucoom op te lossen, vermoedelijk veroorzaakt door mutaties in RAMP's. Deze mutaties hebben wetenschappers verbijsterd omdat de RAMP's op zich geen rol leken te spelen bij de ziekte. Het team van Sakmar werpt nu een nieuwe kijk op glaucoom en een paar soortgelijke raadselachtige ziekten om te ontdekken of een GPCR-interactie de ontbrekende schakel zou kunnen zijn.
Het in beeld brengen van RAMP's kan ook het mysterie oplossen van ongeveer honderd zogenaamde weesreceptoren, die worden geactiveerd door onbekende eiwitten. "Vooruit gaan, we gaan ons concentreren op het vinden van waar deze wees-GPCR's aan binden, "zegt Lorenzen. "Ik hoop dat dit andere mensen zal aanmoedigen om er ook naar te kijken."
 Hoe interageren metalen met DNA?
Hoe interageren metalen met DNA? Zonnecellen:het landschap van op cesium gebaseerde anorganische halide perovskieten in kaart brengen
Zonnecellen:het landschap van op cesium gebaseerde anorganische halide perovskieten in kaart brengen Miniatuurdruppels kunnen een raadsel over de oorsprong van het leven oplossen
Miniatuurdruppels kunnen een raadsel over de oorsprong van het leven oplossen Onderzoekers creëren kunstkraakbeen dat zichzelf kan herstellen
Onderzoekers creëren kunstkraakbeen dat zichzelf kan herstellen Oplosbaarheidsonderzoek kan invloed hebben op energie, biologie, omgeving
Oplosbaarheidsonderzoek kan invloed hebben op energie, biologie, omgeving
Hoofdlijnen
- Is de Krebs-cyclus aëroob of anaëroob?
- Droogteresistente plantengenen kunnen de evolutie van waterbesparende gewassen versnellen
- Wat zijn de functies van de twaalfvingerige darm?
- Energiebesparende LED's stimuleren wereldwijd lichtvervuiling
- Zes soorten neuroglia
- Worden we echt wijzer met de jaren?
- Verkoudheidsvirussen onthullen een van hun sterke punten
- Cellulaire ademhaling in ontkiemende zaden
- Menselijke schedelgroei
- De verrassende kracht van vloeibare kristallen
- Een nieuwe e-nose en computervisie helpen onderzoekers de perfecte kip te koken

- Onderzoeker ontwikkelt een nieuwe, darm-gezonde pindakaas

- Nieuwe strategie voor medicijnontwerp:koperatomen dichterbij houden om bacteriën weg te houden
- Onderzoekers creëren een effectievere hydrogel voor het genezen van wonden

 Steenijzermeteoor veroorzaakte inslagflits van augustus bij Jupiter
Steenijzermeteoor veroorzaakte inslagflits van augustus bij Jupiter Wetenschappers ontwikkelen nieuwe technologie voor de winning van non-ferro en edelmetalen
Wetenschappers ontwikkelen nieuwe technologie voor de winning van non-ferro en edelmetalen Antarctisch zee-ijs 2016, recordlaagte door perfecte storm van tropische, polaire omstandigheden
Antarctisch zee-ijs 2016, recordlaagte door perfecte storm van tropische, polaire omstandigheden Wetenschappers ontdekken dat darmbacteriën in bijen antibioticaresistente genen naar elkaar verspreiden
Wetenschappers ontdekken dat darmbacteriën in bijen antibioticaresistente genen naar elkaar verspreiden Hoe deelbaar te delen door in Excel
Hoe deelbaar te delen door in Excel  De onbenutte kracht van brandstofcellen
De onbenutte kracht van brandstofcellen Een nieuwe draai geven aan Majorana-fermionen
Een nieuwe draai geven aan Majorana-fermionen Lijst van California Wild Finches
Lijst van California Wild Finches
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | French |

-
Wetenschap © https://nl.scienceaq.com

