
Wetenschap
Hoe zou de warmtestroom voor neutralisatie van een zwak zuur met natriumhydroxide zich verhouden tot dat sterke zuur?
De enthalpieverandering voor de neutralisatie van een zwak zuur met natriumhydroxide is kleiner dan die voor een sterk zuur. Dit komt omdat het zwakke zuur niet volledig dissocieert in water, waardoor er minder H+-ionen beschikbaar zijn om met de hydroxide-ionen te reageren. Als gevolg hiervan produceert de reactie niet zoveel warmte.
Vergelijking van warmtestroom voor neutralisatie van zwakke en sterke zuren
De volgende tabel vergelijkt de warmtestroom voor de neutralisatie van een zwak zuur (azijnzuur) en een sterk zuur (zoutzuur) met natriumhydroxide:
| Zuur | Enthalpieverandering (kJ/mol) |
|---|---|
| Azijnzuur | -56,2 |
| Zoutzuur | -57,3 |
Zoals uit de tabel blijkt, is de enthalpieverandering voor de neutralisatie van azijnzuur kleiner dan die voor zoutzuur. Dit komt omdat azijnzuur een zwak zuur is en niet volledig dissocieert in water.
Conclusie
De warmtestroom voor de neutralisatie van een zwak zuur met natriumhydroxide is kleiner dan die voor een sterk zuur, omdat het zwakke zuur niet volledig dissocieert in water. Dit resulteert in minder H+-ionen die beschikbaar zijn om te reageren met de hydroxide-ionen, wat op zijn beurt minder warmte produceert.
 Steenkool onthult een verfijnde kant:vuile koolstof kan worden gebruikt om een verscheidenheid aan nuttige apparaten te maken
Steenkool onthult een verfijnde kant:vuile koolstof kan worden gebruikt om een verscheidenheid aan nuttige apparaten te maken Van ethanol en methanol, dat beter oplosbaar is in water?
Van ethanol en methanol, dat beter oplosbaar is in water?  Nieuwe methode om uit forensisch bewijs teruggevonden zaadcellen te detecteren en te visualiseren
Nieuwe methode om uit forensisch bewijs teruggevonden zaadcellen te detecteren en te visualiseren Een supermateriaal dat toepasbaar is op batterijen en andere apparaten voor energieconversie
Een supermateriaal dat toepasbaar is op batterijen en andere apparaten voor energieconversie Als een zwavelatoom met waterstof mocht reageren, welk molecuul zou er dan ontstaan?
Als een zwavelatoom met waterstof mocht reageren, welk molecuul zou er dan ontstaan?
Hoofdlijnen
- Opinie:Natuurbeschermingsgebieden staan tussen de behoeften van lokale gemeenschappen en het behoud van natuurlijke hulpbronnen in
- Waar wordt zetmeel opgeslagen in plantencellen?
- Waarom zijn er geen huismussen zo groot als ganzen?
- Organisme: definitie, types, kenmerken en voorbeelden
- Op het hek:nieuw onderzoek maakt gebruik van de expertise van ranchers over het leven met carnivoren
- Waarom is het mogelijk om duizenden verschillende soorten eiwitten te hebben met slechts 20 aminozuren?
- Geen levend fossiel:hoe de Coelacanth onlangs tientallen nieuwe genen heeft ontwikkeld
- Hoe grassen inteelt vermijden
- Bijen gebruiken patronen, niet alleen kleuren, om bloemen te vinden
- Franse wetenschappers beweren metallische waterstof te hebben gemaakt
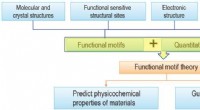
- De cruciale rol van functionele motieven—microstructurele eenheden die materiële functies bepalen—in materiaalonderzoek
- Zeegraszuur en resveratrol voor het eerst geproduceerd door celfabrieken

- Hoogwaardige multimetalen kern-tussenlaag-schil icosahedrale elektrokatalysatoren voor ORR

- Nieuwe methode om celstijfheid te meten kan leiden tot verbeterde kankerbehandelingen

 Nieuwe techniek om geluidsgolven van wanorde te onderdrukken om de optische vezelcommunicatie te verbeteren
Nieuwe techniek om geluidsgolven van wanorde te onderdrukken om de optische vezelcommunicatie te verbeteren Er blijven bedreigingen voor het Amerikaanse stemsysteem en de perceptie van de kiezers over de werkelijkheid
Er blijven bedreigingen voor het Amerikaanse stemsysteem en de perceptie van de kiezers over de werkelijkheid Wat is dichtere terpentijn of water?
Wat is dichtere terpentijn of water?  Neutrino's leveren het eerste experimentele bewijs op van gekatalyseerde fusie die dominant is in veel sterren
Neutrino's leveren het eerste experimentele bewijs op van gekatalyseerde fusie die dominant is in veel sterren In de problemen komen? De kleine oceaanwezens met een wereldwijde impact
In de problemen komen? De kleine oceaanwezens met een wereldwijde impact OpenTitan voor datacenters:Google, partners pushen veilig siliconenontwerp
OpenTitan voor datacenters:Google, partners pushen veilig siliconenontwerp Japan test Shinkansen-bullettrein van de volgende generatie
Japan test Shinkansen-bullettrein van de volgende generatie Waarom koralen niet altijd symbionten doorgeven aan hun nakomelingen
Waarom koralen niet altijd symbionten doorgeven aan hun nakomelingen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

