
Wetenschap
Als 0,500 mol van een niet-elektrolytische opgeloste stof wordt opgelost in 500,0 g ether, wat is dan de vriespuntoplossing?
$$\Delta T_f =K_f \maal m$$
Waar:
- \(\Delta T_f\) is de vriespuntsdaling
- \(K_f\) is de cryoscopische constante van het oplosmiddel
- \(m\) is de molaliteit van de oplossing
In dit geval is het oplosmiddel ether, dat een \(K_f\)-waarde heeft van 2,25 °C/m. De molaliteit van de oplossing is:
$$m =\frac{\text{mol opgeloste stof}}{\text{kilogram oplosmiddel}}$$
We hebben 0,500 mol opgeloste stof en 500,0 g oplosmiddel. Om grammen om te rekenen naar kilogrammen delen we door 1000:
$$m =\frac{0,500 \text{ mol}}{0,500 \text{ kg}} =1,00 \text{ m}$$
Nu kunnen we de waarden van \(K_f\) en \(m\) vervangen in de vergelijking voor \(\Delta T_f\):
$$\Delta T_f =2,25 \text{ °C/m} \times 1,00 \text{ m} =2,25 \text{ °C}$$
Het vriespunt van de oplossing ligt dus 2,25 °C lager dan het vriespunt van pure ether.
 Opinie:Maatregelen van armoede en welzijn negeren nog steeds het milieu – dit moet veranderen
Opinie:Maatregelen van armoede en welzijn negeren nog steeds het milieu – dit moet veranderen Het ritme van verandering:wat een drumbeat-experiment onthult over culturele evolutie
Het ritme van verandering:wat een drumbeat-experiment onthult over culturele evolutie  Tropische bossen kunnen de hitte aan, tot op zekere hoogte
Tropische bossen kunnen de hitte aan, tot op zekere hoogte NASA ziet breed centrum in tropische storm Krosa
NASA ziet breed centrum in tropische storm Krosa Om de voordelen van de natuur te beschermen, focus op mensen
Om de voordelen van de natuur te beschermen, focus op mensen
Hoofdlijnen
- Het team van Rensselaer laat zien hoe je ruwe overheidsdata analyseert
- Voorbeelden van diffusie in orgels
- Hoe evolutie de geometrieën van het leven vormgeeft:wetenschappers lossen een al lang bestaande biologische puzzel op
- Hoe onze mobiele antennes worden gevormd
- Aten Neanderthalers hun groenten? Studie levert het eerste directe bewijs van planten in het Neanderthaler-dieet
- Herintroductie van bizons in graslanden vergroot de plantendiversiteit, droogtebestendigheid, studievondsten
- Hoe is de evolutie begonnen?
- MIT-onderzoeker legt uit hoe ratten denken
- Zouden slaaphaaien op beschermde Steller-zeeleeuwen kunnen jagen?
- Chemici ontwikkelen methode om katalysator-, oppervlakteactieve en sjabloonvrije polymere nanodeeltjes
- Wetenschappers onthullen verborgen katalytisch oppervlak van Ni-Au-kernschil in kooldioxidehydrogenering

- Warmtebehandeling kan chemotherapie effectiever maken
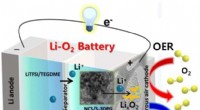
- Een verademing voor batterijen die langer meegaan
- Analytische methoden helpen bij het ontwikkelen van tegengiffen voor cyanide, mosterdgas

 Ambrosia-pollen onder controle houden in Detroit:een no-mow-oplossing voor Motown?
Ambrosia-pollen onder controle houden in Detroit:een no-mow-oplossing voor Motown?  Hoe de pandemie scheuren in wereldwijde toeleveringsketens aan het licht bracht
Hoe de pandemie scheuren in wereldwijde toeleveringsketens aan het licht bracht Waterstofopslag voor auto's?
Waterstofopslag voor auto's?  Natuurkundigen analyseren de rotatiedynamiek van sterrenstelsels en de invloed van de fotonenmassa
Natuurkundigen analyseren de rotatiedynamiek van sterrenstelsels en de invloed van de fotonenmassa Een nieuwe wet ontketent fusie-energie
Een nieuwe wet ontketent fusie-energie Grafenen slapen supergeleiding ontwaakt
Grafenen slapen supergeleiding ontwaakt Het veel voorkomende insecticide dat onze rivieren en wetlands vergiftigt
Het veel voorkomende insecticide dat onze rivieren en wetlands vergiftigt Om erachter te komen hoe sterrenstelsels groeien, zoomen we in op de nachtelijke hemel en leggen we kosmische explosies vast
Om erachter te komen hoe sterrenstelsels groeien, zoomen we in op de nachtelijke hemel en leggen we kosmische explosies vast
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

