
Wetenschap
Wat stelde de atoomtheorie?
1. Wet van behoud van massa :Tijdens een chemische reactie is de totale massa van de producten altijd gelijk aan de totale massa van de reactanten. Dit principe stelde vast dat materie niet kan worden gecreëerd of vernietigd tijdens chemische veranderingen.
2. Wet van bepaalde proporties :Wanneer elementen zich combineren om verbindingen te vormen, doen ze dit in vaste en welomlijnde massaverhoudingen. De verhouding van de massa's van de elementen in een verbinding is constant, ongeacht de hoeveelheid van de verbinding.
3. Wet van meervoudige verhoudingen :Wanneer twee elementen meer dan één verbinding vormen, zijn de massa's van het ene element die gecombineerd worden met een vaste massa van het andere element in eenvoudige verhoudingen van hele getallen.
4. Atomische structuur :Alle materie bestaat uit kleine deeltjes die atomen worden genoemd. Atomen zijn de fundamentele bouwstenen van materie en zijn op chemische wijze ondeelbaar.
5. Onverwoestbaarheid van atomen :Atomen kunnen niet worden gecreëerd of vernietigd tijdens chemische reacties. Ze kunnen alleen worden herschikt om verschillende stoffen te vormen.
6. Homogeniteit van atomen :Alle atomen van een bepaald element zijn identiek wat betreft hun massa, grootte en andere fundamentele eigenschappen.
7. Heterogeniteit van verbindingen :Verbindingen worden gevormd wanneer atomen van verschillende elementen samenkomen. De atomen in een verbinding worden bij elkaar gehouden door chemische krachten.
Daltons atoomtheorie bracht een revolutie teweeg in het begrip van de aard van de materie en legde de basis voor de moderne chemie.
 Wetenschappers ontdekken hoe we zure smaak detecteren
Wetenschappers ontdekken hoe we zure smaak detecteren  Wat is reactiever Br Se of Cl?
Wat is reactiever Br Se of Cl?  Een reactie waarbij licht en twee overgangsmetaalkatalysatoren worden gebruikt om anilinen te maken
Een reactie waarbij licht en twee overgangsmetaalkatalysatoren worden gebruikt om anilinen te maken Katalytische synthese van fenolen met lachgas
Katalytische synthese van fenolen met lachgas Elektronenkristallografie bleek net zo goed te werken als röntgenkristallografie alleen op kleinere kristallen
Elektronenkristallografie bleek net zo goed te werken als röntgenkristallografie alleen op kleinere kristallen
Hoofdlijnen
- Stamcellen tonen de kracht om ziekten en medicijntoxiciteit te voorspellen
- Een vleugje 'liefdeshormoon' helpt apen een beetje vriendelijkheid te tonen
- Van wild tot gedomesticeerd:wetenschappers onthullen 100.000 jaar voortdurende evolutie van rijst
- Wat bestaat uit een cellichaam, dendrieten en axonen?
- Structurele kenmerken van blauwgroene algen
- Waarom gapen besmettelijk is bij bonobo's
- Is er verteld dat je te gevoelig bent? Je zou een empaat kunnen zijn
- Wat betekent oxiatie?
- Uit onderzoek blijkt hoe vrouwtjes het 'juiste' sperma kiezen
- Experimenten testen hoe gemakkelijk het leven zelf kan zijn

- Ontdekking van hoe mensen de geur van de dood ervaren, kan levens redden

- Nieuwe doorbraak in nanotechnologie die atmosferische koolstof gebruikt om nuttige chemicaliën te maken

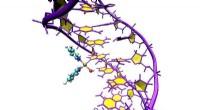
- Hoe interageren metalen met DNA?
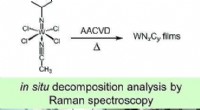
- Gesimuleerde chemische dampafzetting van een wolfraamcarbonitride-precursor
 Hoe verhouden milieu en vrede zich tot elkaar?
Hoe verhouden milieu en vrede zich tot elkaar?  Vorm geven aan de manier waarop de vervormbaarheid van rode bloedcellen wordt beoordeeld:onderzoekers ontwikkelen een nieuwe aanpak
Vorm geven aan de manier waarop de vervormbaarheid van rode bloedcellen wordt beoordeeld:onderzoekers ontwikkelen een nieuwe aanpak  Een nieuwe interpretatie van petrogenese van de vroege continentale korst van de aarde
Een nieuwe interpretatie van petrogenese van de vroege continentale korst van de aarde Focus op voedsel zou helpen bij het oplossen van klimaatverandering, zegt studie
Focus op voedsel zou helpen bij het oplossen van klimaatverandering, zegt studie Doelstellingen schrijven voor labrapporten
Doelstellingen schrijven voor labrapporten  Wat zijn de aanpassingen van een eeuwplant?
Wat zijn de aanpassingen van een eeuwplant?  Wat heeft Max Plank gedaan?
Wat heeft Max Plank gedaan?  Een nieuw type koeling voor kwantumsimulators
Een nieuw type koeling voor kwantumsimulators
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

