
Wetenschap
Welke veranderingen vinden plaats wanneer een stof een faseverandering ondergaat?
1. Vast naar vloeibaar (smelten) :
- De stof absorbeert energie in de vorm van warmte.
- De deeltjes van de stof krijgen kinetische energie en beginnen krachtiger te trillen.
- De aantrekkingskrachten tussen de deeltjes worden zwakker, waardoor ze vrijer kunnen bewegen.
- De substantie verandert van een stijve en goed gedefinieerde vorm (vast) naar een vloeibare en niet-stijve vorm (vloeistof).
- Het volume van de stof zet gewoonlijk enigszins uit als gevolg van de toegenomen moleculaire beweging.
- Het smeltpunt is de specifieke temperatuur waarbij een stof overgaat van een vaste naar een vloeibare toestand.
2. Vloeistof naar gas (verdamping) :
- De stof absorbeert continu energie in de vorm van warmte.
- De deeltjes van de stof krijgen nog meer kinetische energie, waardoor hun snelheid en trillingsbeweging toenemen.
- De aantrekkingskrachten tussen de deeltjes worden verwaarloosbaar, waardoor ze onafhankelijk kunnen bewegen.
- De substantie verandert van een vloeistof met een bepaald volume in een gas dat uitzet om de container te vullen.
- Het volume van de stof neemt aanzienlijk toe naarmate de deeltjes verder uit elkaar bewegen.
- Het kookpunt is de specifieke temperatuur waarbij een vloeistof onder een gegeven druk overgaat in een gasvormige toestand.
3. Gas naar vloeistof (condensatie) :
- De stof verliest energie in de vorm van warmte aan de omgeving.
- De gasdeeltjes vertragen en verliezen kinetische energie, wat resulteert in een verminderde moleculaire beweging.
- De aantrekkingskrachten tussen de deeltjes worden sterker, waardoor ze dichter bij elkaar komen.
- Het gas verandert in een vloeistof terwijl de deeltjes condenseren tot een compactere vorm.
- Het volume van de stof neemt aanzienlijk af in vergelijking met de gasvormige toestand.
- Het condensatiepunt is de temperatuur waarbij een gas onder een bepaalde druk overgaat in een vloeistof.
4. Vast naar gas (sublimatie) :
- Dit gebeurt wanneer een vaste stof direct in een gas verandert zonder door de vloeibare toestand te gaan.
- De vaste deeltjes absorberen energie, verkrijgen kinetische energie en overwinnen de aantrekkingskrachten ertussen.
- Sublimatie vindt plaats bij temperaturen en drukken onder het tripelpunt van een stof, waarbij de drie fasen (vast, vloeibaar en gas) naast elkaar kunnen bestaan.
- Stoffen die gemakkelijk sublimeren worden vluchtig genoemd, zoals droogijs (vast kooldioxide).
5. Vloeibaar naar vast (bevriezen) :
- Het omgekeerde van smelten, waarbij een vloeistof energie in de vorm van warmte aan de omgeving verliest.
- De vloeibare deeltjes vertragen, verliezen kinetische energie en worden meer geordend.
- De aantrekkingskrachten tussen de deeltjes worden sterker, waardoor ze een stijve structuur vormen.
- De substantie gaat over van een vloeistof met een bepaalde vorm naar een vaste stof met een vaste vorm en volume.
- Het vriespunt is de temperatuur waarbij een vloeistof onder een bepaalde druk overgaat in een vaste stof.
Het is belangrijk op te merken dat deze faseveranderingen kunnen worden beïnvloed door factoren zoals temperatuur, druk en intermoleculaire krachten in de stof. Verschillende stoffen hebben verschillende faseveranderingstemperaturen, en sommige kunnen deze overgangen met verschillende snelheden ondergaan.
 'S Werelds eerste demonstratie van aanhoudende luminescentie van organische materialen, klaar om nieuwe, uitgebreid gebruik
'S Werelds eerste demonstratie van aanhoudende luminescentie van organische materialen, klaar om nieuwe, uitgebreid gebruik Gebruikmaken van geometrische frustratie om batterijen af te stemmen voor meer vermogen
Gebruikmaken van geometrische frustratie om batterijen af te stemmen voor meer vermogen Wetenschappers onderzoeken 3D-geprinte legeringen met hoge entropie
Wetenschappers onderzoeken 3D-geprinte legeringen met hoge entropie Het percentage per volume berekenen
Het percentage per volume berekenen  Welke vaste stof vormt een uitzondering op de regel dat vaste stoffen een hogere dichtheid hebben dan vloeistoffen?
Welke vaste stof vormt een uitzondering op de regel dat vaste stoffen een hogere dichtheid hebben dan vloeistoffen?
 Dood door ontwerp? Ruimtelijke modellen laten zien dat natuurlijke selectie een genetisch beperkte levensduur als lineair voordeel bevoordeelt
Dood door ontwerp? Ruimtelijke modellen laten zien dat natuurlijke selectie een genetisch beperkte levensduur als lineair voordeel bevoordeelt  NASA kijkt naar het Louisiana-deltasysteem, ogen wereldwijde voorspellingen
NASA kijkt naar het Louisiana-deltasysteem, ogen wereldwijde voorspellingen IJskapstudie belooft nieuwe vooruitzichten voor nauwkeurige lokale klimaatprojecties internationaal
IJskapstudie belooft nieuwe vooruitzichten voor nauwkeurige lokale klimaatprojecties internationaal Orkaan Fiona raast over Canada nadat ze Bermuda overspoeld heeft
Orkaan Fiona raast over Canada nadat ze Bermuda overspoeld heeft Wat heeft er misschien voor gezorgd dat bomen de prairies van uw geboorteland niet hebben overgenomen voordat de landbouw begon?
Wat heeft er misschien voor gezorgd dat bomen de prairies van uw geboorteland niet hebben overgenomen voordat de landbouw begon?
Hoofdlijnen
- Hoe kunnen slechts 4 basen in rna instructies bevatten voor 20 aminozuren?
- Dromen hagedissen als mensen?
- Hoeveel spieren heb je nodig om te glimlachen?
- Zeven nieuwe spinnensoorten uit Brazilië vernoemd naar zeven beroemde fictieve spinnenpersonages
- Waar vindt glucoserosorbtie plaats?
- Hoe sauropoden zich een weg baanden naar gigantisme
- Hoe het eerste katachtige sabeltandroofdier werd ontdekt en waarom het verschilt van moderne katten
- Hoe T-cellen ervoor zorgen dat ze rust hebben
- Native Plants & Animals of France
- ASU-onderzoek siert cover van ACS-tijdschrift

- Collageen-nanofibrillen in weefsels van zoogdieren worden sterker bij inspanning

- Expert:het gebruik van koolstof is de sleutel tot het koolstofarm maken van de economie

- De zoete smaak van succes voor een ondersteunde nikkelfosfide-nanolegeringskatalysator
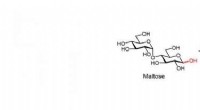
- Onderzoekers ontdekken unieke multifibrillaire vezels

 Vijftien nieuwe veranderlijke sterren gedetecteerd in de melkweg NGC 247
Vijftien nieuwe veranderlijke sterren gedetecteerd in de melkweg NGC 247 Met Comcast uit, hoe Disney's imperium eruit zal zien met Fox
Met Comcast uit, hoe Disney's imperium eruit zal zien met Fox Wetenschappers maken een vanadiumstroombatterijmodel
Wetenschappers maken een vanadiumstroombatterijmodel De nieuwe Tuned-berichtenapp van Facebook is alleen voor koppels
De nieuwe Tuned-berichtenapp van Facebook is alleen voor koppels Van triviaal probleem tot primetime-tv - een reis van onderzoekers door plastic
Van triviaal probleem tot primetime-tv - een reis van onderzoekers door plastic Voordelen & nadelen van woestijnen
Voordelen & nadelen van woestijnen Apple stelt iPhones in om de locatie voor 911-oproepen door te geven
Apple stelt iPhones in om de locatie voor 911-oproepen door te geven Wat is het gebruik van zoutzuur bij het testen op niet-reducerende suiker?
Wat is het gebruik van zoutzuur bij het testen op niet-reducerende suiker?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

