
Wetenschap
In ionische verbindingen Is het smeltpunt hoog of laag?
Ionische verbindingen worden bij elkaar gehouden door sterke elektrostatische krachten tussen positief en negatief geladen ionen. Deze krachten zijn sterker dan de Van der Waals-krachten die moleculen in covalente verbindingen bij elkaar houden. Daarom hebben ionische verbindingen hogere smeltpunten dan covalente verbindingen.
Het smeltpunt van een ionische verbinding is de temperatuur waarbij de vaste fase overgaat in de vloeibare fase. Bij deze temperatuur is de kinetische energie van de ionen groot genoeg om de onderlinge aantrekkingskrachten te overwinnen en kunnen ze langs elkaar heen bewegen. Hoe hoger het smeltpunt, hoe sterker de aantrekkingskrachten tussen de ionen.
Het smeltpunt van een ionische verbinding hangt af van een aantal factoren, waaronder de lading van de ionen, de grootte van de ionen en de roosterenergie. De lading van de ionen is de belangrijkste factor. Hoe groter de lading van de ionen, hoe sterker de aantrekkingskrachten ertussen en hoe hoger het smeltpunt. De grootte van de ionen speelt ook een rol. Hoe kleiner de ionen, hoe dichter ze bij elkaar kunnen komen en hoe sterker de aantrekkingskrachten daartussen. Dit is de reden waarom ionische verbindingen met kleine ionen hogere smeltpunten hebben dan ionische verbindingen met grote ionen. Ten slotte is de roosterenergie ook een factor. De roosterenergie is de energie die nodig is om alle ionen in een kristalrooster te scheiden. Hoe hoger de roosterenergie, hoe sterker de aantrekkingskrachten tussen de ionen en hoe hoger het smeltpunt.
 Krachtige aardbeving wekt mensen uit hun slaap in Zuid-Filippijnen
Krachtige aardbeving wekt mensen uit hun slaap in Zuid-Filippijnen De winter begint te laat in het normaal koude, landelijke Alaska
De winter begint te laat in het normaal koude, landelijke Alaska Leven op de bodem van de Noordelijke IJszee, met strengheid en in detail
Leven op de bodem van de Noordelijke IJszee, met strengheid en in detail Hittegolf veroorzaakt enorme smelting van Groenlandse ijskap
Hittegolf veroorzaakt enorme smelting van Groenlandse ijskap Wat motiveert beleidsmakers op het gebied van natuurlijke hulpbronnen in Afrika om actie te ondernemen tegen klimaatverandering?
Wat motiveert beleidsmakers op het gebied van natuurlijke hulpbronnen in Afrika om actie te ondernemen tegen klimaatverandering?
Hoofdlijnen
- Terwijl chinook-zalmen dunner en minder worden, hebben orka's die in het zuiden wonen moeite om voldoende voedsel te vinden
- Uitgestorven houtetende kakkerlak na 80 jaar herontdekt
- Nu kunnen onderzoekers zien hoe ongevouwen eiwitten in de cel bewegen
- Onderzoek toont aan hoe kunststoffen de biodiversiteit van het zeeleven bedreigen
- De uitbraak van het coronavirus roept de vraag op:waarom zijn vleermuisvirussen zo dodelijk?
- Industrieel gebruik van Pepsin
- Experiment laat zien hoe wormgastheren en het bijbehorende microbioom gezamenlijk bijdragen aan aanpassing aan het milieu
- Nieuw mechanisme verduidelijkt hoe cellen migreren
- "What Does Heterozygous Mean?
- Gevoelige nieuwe test detecteert antilichamen tegen SARS-CoV-2 in slechts 10 minuten

- Nieuw ontwikkelde geëvolueerde enzymen produceren hernieuwbaar isobuteen

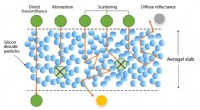
- Aerogels voor zonne-apparaten en ramen
- Katalysatoronderzoek voor zonnebrandstoffen:amorf molybdeensulfide werkt het beste

- Nieuwe draaitafelachtige katalytische reactor belooft duurzamere chemische productie

 NASA ziet tropische cycloon Gita verzwakken
NASA ziet tropische cycloon Gita verzwakken Nucleair Hoe fusiereactoren werken
Nucleair Hoe fusiereactoren werken  Satellietanalyse op lange termijn laat zien dat het regenseizoen nu natter is dan ooit
Satellietanalyse op lange termijn laat zien dat het regenseizoen nu natter is dan ooit Wat gebeurt er als we RBC in een hypotone oplossing plaatsen?
Wat gebeurt er als we RBC in een hypotone oplossing plaatsen?  Goede trillingen:nieuwe producten op atoomschaal aan de horizon
Goede trillingen:nieuwe producten op atoomschaal aan de horizon Waarom trouw je niet met je neef? Miljoenen doen dat
Waarom trouw je niet met je neef? Miljoenen doen dat  Nieuwe aardverschuivingen in Zwitserse Alpen zorgen voor meer evacuaties
Nieuwe aardverschuivingen in Zwitserse Alpen zorgen voor meer evacuaties Kan een app uw romantische relatie verbeteren?
Kan een app uw romantische relatie verbeteren?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

