
Wetenschap
Hoeveel valentie-elektronen moeten er in de Lewis-structuur voor LiCl worden ondergebracht?
- Lithium (Li) behoort tot Groep 1 en heeft één valentie-elektron in de buitenste schil.
- Chloor (Cl) behoort tot Groep 17 en heeft zeven valentie-elektronen in de buitenste schil.
Om LiCl te vormen, zal het lithiumatoom zijn ene valentie-elektron overdragen aan het chlooratoom. Dit resulteert in een compleet octet voor chloor, waardoor een stabiele configuratie wordt bereikt.
In de Lewis-structuur vertegenwoordigen we de valentie-elektronen als stippen rond de atomaire symbolen:
```
:Cl-Li:
```
Daarom zijn er in de Lewis-structuur voor LiCl in totaal 8 valentie-elektronen moeten worden ondergebracht - één uit lithium en zeven uit chloor, om aan de octetregel te voldoen.
 Is Na2O een polair covalent molecuul?
Is Na2O een polair covalent molecuul?  Bellenvangend oppervlak helpt bij het verwijderen van schuim
Bellenvangend oppervlak helpt bij het verwijderen van schuim Is xenongas een element of een heterogeen mengsel van een homogeen mengsel?
Is xenongas een element of een heterogeen mengsel van een homogeen mengsel?  Van vloeistof naar vast:hoe lang duurt het voordat water bevriest?
Van vloeistof naar vast:hoe lang duurt het voordat water bevriest?  Een nieuwe katalysator voor watersplitsing die het beste van twee werelden is
Een nieuwe katalysator voor watersplitsing die het beste van twee werelden is
 Wat zijn sommige vogels in Michigan?
Wat zijn sommige vogels in Michigan?  Onderzoek vindt een nieuwe manier om voedselverspilling te verminderen
Onderzoek vindt een nieuwe manier om voedselverspilling te verminderen De Amerikaanse aardgasindustrie lekt veel meer methaan dan eerder werd gedacht. Dit is waarom dat ertoe doet
De Amerikaanse aardgasindustrie lekt veel meer methaan dan eerder werd gedacht. Dit is waarom dat ertoe doet Methaanuitstoot uit verlaten olie- en gasbronnen onderschat
Methaanuitstoot uit verlaten olie- en gasbronnen onderschat Tibet's verbannen moslims tonen de complexiteit van cultuur en identiteit voor vluchtelingen
Tibet's verbannen moslims tonen de complexiteit van cultuur en identiteit voor vluchtelingen
Hoofdlijnen
- Waarom zouden wetenschappers een hybride mens-koe-embryo willen creëren?
- Bioloog uit Syracuse onthult hoe walvissen kunnen 'zingen' voor hun avondeten
- Chemisch 'oriëntatielopen':hoe nauwkeurig kunnen cellen een chemisch spoor volgen om hun weg te vinden?
- Dit is het seizoen om waakzaam te zijn:het risico op chocoladevergiftiging bij honden piekt met Kerstmis
- Verschillende Agar-platen
- Begrijpen hoe het COVID-19-virus het lichaam binnendringt en medicijnen die de infectie kunnen verzachten
- Wat bijendodende mijten ons kunnen leren over de evolutie van parasieten
- Hoe sociale media de menselijke beschaving hebben gesynchroniseerd
- Nieuw onderzoek om te onderzoeken hoe vaardigheden het resultaat van dierengevechten beïnvloeden
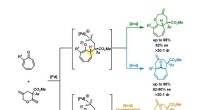
- Uiteenlopende synthese van bicyclische middelgrote ringstructuren
- Nieuwe printtechniek gebruikt cellen en moleculen om biologische structuren na te bootsen

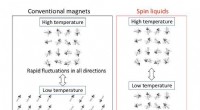
- Van overvloedige koolwaterstoffen tot zeldzame spinvloeistoffen
- Het regelen van warmte opent de deur voor verlichting en displays van de volgende generatie in perovskiet-LED's

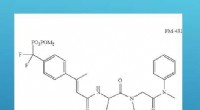
- David vs Goliath:hoe een klein molecuul astma-aanvallen kan verslaan
 bossen, koolstofputten, kan vertragingen bij het koolstofarm maken van de economie niet goedmaken:studie
bossen, koolstofputten, kan vertragingen bij het koolstofarm maken van de economie niet goedmaken:studie Quantum wapening:Quantum dots verbeteren de stabiliteit van perovskietkristallen die zonne-energie oogsten
Quantum wapening:Quantum dots verbeteren de stabiliteit van perovskietkristallen die zonne-energie oogsten Nieuwe methode voorspelt spindynamiek van materialen voor quantum computing
Nieuwe methode voorspelt spindynamiek van materialen voor quantum computing Mos detecteert snel, volgt luchtverontreinigende stoffen in realtime
Mos detecteert snel, volgt luchtverontreinigende stoffen in realtime Als het interne ecosysteem van de darmen in de war raakt, kan een eeuwenoude, maar grof klinkende behandeling dit dan goed maken?
Als het interne ecosysteem van de darmen in de war raakt, kan een eeuwenoude, maar grof klinkende behandeling dit dan goed maken?  Hoe maak je een grafiek van Celsius naar Fahrenheit
Hoe maak je een grafiek van Celsius naar Fahrenheit Aardbeving in 2009 versterkte de stijgende zeespiegel in Amerikaans Samoas
Aardbeving in 2009 versterkte de stijgende zeespiegel in Amerikaans Samoas De snelheid van twee verschillende katrollen berekenen
De snelheid van twee verschillende katrollen berekenen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

