
Wetenschap
Waarom Een lithiumatoom (Li) vormt een ionische binding met chloor (Cl) om chloride te vormen. Hoe hebben de valentie-elektronen van deze atomen deze binding herschikt?
Wanneer lithium- (Li) en chloor- (Cl) atomen een interactie aangaan om een ionische binding te vormen, ondergaan hun valentie-elektronen een herschikking om een stabiele elektronenconfiguratie te bereiken. Hier ziet u hoe het gebeurt:
1. Initiële elektronenconfiguraties:
- Lithium (Li):1s²2s¹ (3 valentie-elektronen)
- Chloor (Cl):1s²2s²2p⁶3s²3p⁵ (7 valentie-elektronen)
2. Elektronenoverdracht:
- Lithium draagt zijn ene valentie-elektron over aan chloor.
- Chloor accepteert dit elektron en wordt negatief geladen.
- Als gevolg hiervan verliest lithium een elektron en wordt het positief geladen, terwijl chloor een elektron krijgt en negatief geladen wordt.
3. Vorming van ionen:
- Het lithiumatoom verliest zijn enige valentie-elektron, wat resulteert in een positief geladen lithiumion (Li⁺) met een elektronenconfiguratie van 1s².
- Het chlooratoom krijgt een extra elektron, wat resulteert in een negatief geladen chloride-ion (Cl⁻) met een elektronenconfiguratie van 1s²2s²2p⁶3s²3p⁶.
4. Ionische bindingsvorming:
- De elektrostatische aantrekkingskracht tussen het positief geladen lithiumion (Li⁺) en het negatief geladen chloride-ion (Cl⁻) houdt ze bij elkaar en vormt een ionische binding.
Samenvattend impliceert de vorming van een ionische binding tussen lithium en chloor de overdracht van één valentie-elektron van lithium naar chloor, wat resulteert in de vorming van positief geladen lithiumionen (Li⁺) en negatief geladen chloride-ionen (Cl⁻). Deze ionen worden vervolgens bij elkaar gehouden door de sterke elektrostatische aantrekkingskracht tussen tegengestelde ladingen, waardoor de ionische verbinding lithiumchloride (LiCl) ontstaat.
 Is ductiel en kneedbaar een chemische eigenschap of een fysische eigenschap?
Is ductiel en kneedbaar een chemische eigenschap of een fysische eigenschap?  Wat is het oxidatiegetal voor LiBr?
Wat is het oxidatiegetal voor LiBr?  Wat is de molaliteit van een oplossing van 75,2 g AgClO4 opgelost in 885 C6H6?
Wat is de molaliteit van een oplossing van 75,2 g AgClO4 opgelost in 885 C6H6?  Toevallige ontdekking van sterke en onbreekbare moleculaire schakelaar
Toevallige ontdekking van sterke en onbreekbare moleculaire schakelaar Een fatale fout van een batterij overwinnen
Een fatale fout van een batterij overwinnen
Hoofdlijnen
- Hoe zijn cellen, weefsels en organen verwant?
- Op weg naar pesticidebewaking
- Reizen de voedingsstoffen door zuurstofarm bloed om de lichaamscel te bereiken?
- Nieuw onderzoek werpt licht op hoe cellen die honger hebben naar voedingsstoffen interne componenten recyclen
- Commensalisme: definitie, types, feiten en voorbeelden
- Computersimulaties geven aanwijzingen over hoe cellen omgaan met hun omgeving
- Bioprospectie van het onbekende:hoe bacteriële enzymen gecodeerd door onbekende genen kunnen helpen bij het opruimen van vervuiling
- Onderzoek toont aan hoe het dieet van een hond zijn darmmicrobioom vormt
- Wat is het verschil tussen gametogenese bij vrouwelijke zoogdieren en mannelijke zoogdieren?
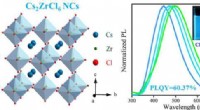
- Wetenschappers synthetiseren loodvrije op zirkonium gebaseerde vacature-geordende dubbele perovskiet nanokristallen
- Batterijonderzoek:nieuwe doorbraken in onderzoek naar superbatterijen
- Duurzaam, zeer selectieve biokatalytische omzetting van aldehyden in carbonzuren

- Switch-in-a-cell elektriseert het leven
- Nieuwe productiemethode voor fullereenkristal 50 keer sneller dan zijn voorganger

 Amerikaanse energiemarkt bleek de afgelopen tien jaar instabieler te zijn
Amerikaanse energiemarkt bleek de afgelopen tien jaar instabieler te zijn Wat is grafeen? Het verbijsterende wondermateriaal
Wat is grafeen? Het verbijsterende wondermateriaal  Hoeveel mol zit er in een gasmonster in een container van 0,325 liter bij 0,914 ATM en 19 graden Celsius?
Hoeveel mol zit er in een gasmonster in een container van 0,325 liter bij 0,914 ATM en 19 graden Celsius?  Lake Erie voorziet meer mensen van drinkwater dan enig ander, maar algenbloei maakt het giftig
Lake Erie voorziet meer mensen van drinkwater dan enig ander, maar algenbloei maakt het giftig Bodem bevat een van de sleutels tot klimaatakkoord
Bodem bevat een van de sleutels tot klimaatakkoord Een draai aan atomaire platen om nieuwe materialen te creëren
Een draai aan atomaire platen om nieuwe materialen te creëren  Biomoleculen lokaliseren met nanometernauwkeurigheid
Biomoleculen lokaliseren met nanometernauwkeurigheid Studie:Sociale diversiteit is in eerste instantie bedreigend, maar mensen passen zich in de loop van de tijd aan
Studie:Sociale diversiteit is in eerste instantie bedreigend, maar mensen passen zich in de loop van de tijd aan
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

