
Wetenschap
Wat gebeurt er met ionische en covalente verbindingen als ze in water worden opgelost?
Ionische verbindingen:
1. Dissociatie: Ionische verbindingen, zoals natriumchloride (NaCl), ondergaan een proces dat dissociatie wordt genoemd wanneer ze in water worden opgelost. De watermoleculen omringen de ionen die in de verbinding aanwezig zijn, waardoor de elektrostatische aantrekkingskracht tussen hen wordt verbroken. Als gevolg hiervan dissocieert de verbinding in zijn individuele ionen. NaCl dissocieert bijvoorbeeld in Na⁺- en Cl⁻-ionen wanneer het in water wordt opgelost.
2. Hydratatie: Zodra de ionen zijn gescheiden, worden ze omgeven door watermoleculen via een proces dat bekend staat als hydratatie. Watermoleculen vormen waterstofbruggen met de ionen, waardoor een "hydratatiesfeer" rond elk ion ontstaat. Deze hydratatiesfeer stabiliseert de ionen in de oplossing.
3. Vorming van gehydrateerde ionen: De gehydrateerde ionen kunnen nu onafhankelijk in het water bewegen, omringd door hun hydratatiebollen. Deze gehydrateerde ionen behouden hun lading en dragen bij aan de elektrische geleidbaarheid van de oplossing.
Covalente verbindingen:
1. Polariteit: Covalente verbindingen kunnen polair of niet-polair zijn. Polaire covalente verbindingen, zoals waterstofchloride (HCl), hebben een gedeeltelijk positieve lading op het ene atoom en een gedeeltelijk negatieve lading op het andere. Door deze polariteit kunnen ze interageren met watermoleculen.
2. Waterstofbinding: Polaire covalente verbindingen kunnen waterstofbruggen vormen met watermoleculen. Het elektronegatieve atoom in de covalente verbinding trekt de waterstof gedeeltelijk uit het watermolecuul aan, wat resulteert in de vorming van waterstofbruggen. Deze waterstofbinding verhoogt de oplosbaarheid van de covalente verbinding in water.
3. Gedeeltelijke dissociatie: In sommige gevallen kunnen polaire covalente verbindingen gedeeltelijk dissociëren in water, waardoor ionen in de oplossing vrijkomen. HCl ondergaat bijvoorbeeld een gedeeltelijke dissociatie in water, waarbij H⁺- en Cl⁻-ionen vrijkomen, zij het in mindere mate vergeleken met ionische verbindingen.
4. Hydratatie van polaire moleculen: Polaire covalente moleculen kunnen ook gehydrateerd raken, hoewel de hydratatie zwakker is vergeleken met gehydrateerde ionen. De gedeeltelijke ladingen op het molecuul werken samen met de tegengesteld geladen polen van watermoleculen, wat leidt tot hydratatie.
5. Beperkte oplosbaarheid: Niet-polaire covalente verbindingen vormen daarentegen geen waterstofbruggen en dissociëren niet in water. Ze zijn doorgaans niet mengbaar met water, wat betekent dat ze niet in water oplossen. Niet-polaire moleculen zijn beter oplosbaar in organische oplosmiddelen.
Samenvattend dissociëren ionische verbindingen in gehydrateerde ionen wanneer ze in water worden opgelost, terwijl polaire covalente verbindingen waterstofbruggen kunnen vormen en gedeeltelijke dissociatie kunnen ondergaan. Niet-polaire covalente verbindingen zijn over het algemeen niet mengbaar met water. De oplosbaarheid en het gedrag van verbindingen in water zijn afhankelijk van hun chemische eigenschappen en de polariteit van het oplosmiddel.
 Onderzoekers vliegen en zeilen naar de meest stormachtige plek op aarde om wolkenprocessen te bestuderen
Onderzoekers vliegen en zeilen naar de meest stormachtige plek op aarde om wolkenprocessen te bestuderen Sprankelende stranden:Cyprus heeft schoonste wateren in de EU
Sprankelende stranden:Cyprus heeft schoonste wateren in de EU Hoe geven olifanten geboorte?
Hoe geven olifanten geboorte?  Onder druk:hoe kamgelei zich heeft aangepast aan het leven op de bodem van de oceaan
Onder druk:hoe kamgelei zich heeft aangepast aan het leven op de bodem van de oceaan  Welke plantenpigmenten worden in andere planten aangetroffen dan de groene pigmenten?
Welke plantenpigmenten worden in andere planten aangetroffen dan de groene pigmenten?
Hoofdlijnen
- Wat maakt fotosynthese?
- Het Nederlandse landschap verliest door insecten bestoven planten, zo blijkt uit 87 jaar data
- Celdeling: hoe werkt het?
- Genetisch verhogen van de voedingswaarde van maïs kan miljoenen ten goede komen
- Onderzoekers willen de darmgezondheid van vee verbeteren
- Hoe is variatie gunstig voor een populatie van organismen?
- Computermodellen leggen uit hoe dieren acties selecteren met lonende resultaten
- Mussenkuikens kunnen het nummer identificeren vanaf de openingsnoot
- Hoe jagen spinnen 'in koor'?
- Enzym bleek de vorming van collageendragers te beheersen en de collageenafscheiding te remmen
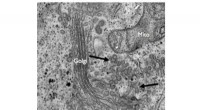
- Nanotechnologie stelt ingenieurs in staat om voorheen niet-lasbare aluminiumlegeringen te lassen

- Onderzoekers ontwikkelen selectieve elektrokatalysatoren om de prestaties van directe methanol-brandstofcellen te verbeteren
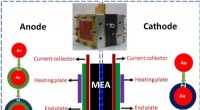
- Nieuwe exfoliatietechniek herstelt piëzo-elektriciteit van biomaterialen

- Het maken van mRNA met een volledig chemisch proces kan aangepaste mRNA-vaccins mogelijk maken

 Een zonnestelsel bouwen voor een wetenschapsbeurs
Een zonnestelsel bouwen voor een wetenschapsbeurs De hitte voelen:Tokio bereidt zich voor op de zinderende Olympische Zomerspelen
De hitte voelen:Tokio bereidt zich voor op de zinderende Olympische Zomerspelen Klimaatverandering en extreem weer die migratie stimuleren
Klimaatverandering en extreem weer die migratie stimuleren Nieuw onderzoek:wordt de wereldwijde achteruitgang van de honingbij veroorzaakt door dieselvervuiling?
Nieuw onderzoek:wordt de wereldwijde achteruitgang van de honingbij veroorzaakt door dieselvervuiling?  Rekbaar keramiek gemaakt door vlamtechnologie
Rekbaar keramiek gemaakt door vlamtechnologie Drieduizend jaar aan koolmonoxideregistraties laten een positief effect zien van de mondiale interventies in de jaren tachtig
Drieduizend jaar aan koolmonoxideregistraties laten een positief effect zien van de mondiale interventies in de jaren tachtig  Onderzoekers verrasten microplastics te vinden in lagunes van Florida Keys
Onderzoekers verrasten microplastics te vinden in lagunes van Florida Keys Egypte zegt nog een schat aan oude doodskisten gevonden in Saqqara
Egypte zegt nog een schat aan oude doodskisten gevonden in Saqqara
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

