
Wetenschap
Op welke manieren is een structuurformule een inadequate weergave van het werkelijke molecuul?
1. Driedimensionale structuur:
Structuurformules worden doorgaans op een tweedimensionaal vlak getekend, dat niet de driedimensionale rangschikking van atomen in een molecuul weergeeft. Deze beperking is vooral belangrijk voor complexe moleculen met ingewikkelde ruimtelijke structuren. Veel kenmerken, zoals moleculaire vorm, bindingshoeken en ruimtelijke oriëntaties, zijn niet duidelijk in een structuurformule.
2. Bondlengtes en -hoeken:
Structuurformules geven geen nauwkeurige informatie over de verbindingslengtes en verbindingshoeken. De lijnen die bindingen voorstellen, zijn vaak even lang getekend, wat bij echte moleculen niet altijd het geval is. De lengtes en hoeken van bindingen kunnen variëren afhankelijk van de aard van de betrokken atomen en de hybridisatie van orbitalen.
3. Stereochemie:
Structuurformules missen vaak stereochemische details, die cruciaal zijn voor het begrijpen van de ruimtelijke ordening van atomen in de driedimensionale ruimte. Enantiomeren, die spiegelbeelden van elkaar zijn, kunnen niet worden onderscheiden met behulp van alleen een structuurformule. De structuurformule van melkzuur specificeert bijvoorbeeld niet of het om de L- of D-enantiomeer gaat.
4. Elektronenverdeling en binding:
Structuurformules laten niet expliciet de verdeling van elektronen binnen een molecuul zien, of de aard van chemische bindingen. Ze geven geen informatie over elektronenparen, alleenstaande paren of de moleculaire orbitalen die betrokken zijn bij binding. Dit aspect is cruciaal voor het begrijpen van de elektronische eigenschappen en reactiviteit van een molecuul.
5. Dynamische aard van moleculen:
Structuurformules portretteren moleculen als statische entiteiten, wat geen nauwkeurige weergave is van hun dynamische gedrag. Moleculen ondergaan constante trillingen, rotaties en conformationele veranderingen. Structurele formules slagen er niet in deze dynamische aard vast te leggen en vertegenwoordigen mogelijk niet de meest stabiele of meest voorkomende conformatie van een molecuul.
6. Oplossing en interacties:
Structuurformules geven doorgaans geïsoleerde moleculen weer, terwijl moleculen in werkelijkheid voorkomen in een omgeving omringd door oplosmiddelmoleculen of een interactie aangaan met andere moleculen. Deze interacties, zoals waterstofbruggen, dipool-dipoolkrachten en van der Waals-krachten, worden niet weergegeven in structuurformules.
Ondanks hun beperkingen blijven structuurformules een nuttig hulpmiddel voor het overbrengen van basisinformatie over de samenstelling en connectiviteit van moleculen. Het is echter essentieel om hun beperkingen te onderkennen en deze aan te vullen met andere representaties, zoals driedimensionale modellen, elektronendichtheidskaarten en moleculaire orbitalen, om een beter begrip te krijgen van de moleculaire structuur en eigenschappen.
 NASA-waterdampbeelden tonen Tinos potentieel voor zware regen boven Fiji
NASA-waterdampbeelden tonen Tinos potentieel voor zware regen boven Fiji NASA vangt de overgang van tropische storm Francisco in de buurt van het Koreaanse schiereiland
NASA vangt de overgang van tropische storm Francisco in de buurt van het Koreaanse schiereiland Stedenbouwkundig beleid draagt bij aan politieke polarisatie
Stedenbouwkundig beleid draagt bij aan politieke polarisatie kroniek van de complexe ecologische veranderingen veroorzaakt door de steeds vluchtigere El Niño – La Niña-cycli
kroniek van de complexe ecologische veranderingen veroorzaakt door de steeds vluchtigere El Niño – La Niña-cycli Devoon integratieve stratigrafie en tijdschaal van China
Devoon integratieve stratigrafie en tijdschaal van China
Hoofdlijnen
- Was de vroege evolutie van dieren coöperatief?
- Hoe bacteriën hun motoren turbochargeerden
- Tunesische hangende tuinboerderijen houden stand ondanks droogte
- Hoe Cytoplasma voor een celproject te maken
- Eenvoudig epitheelweefsel: definitie, structuur en voorbeelden
- Hoe mechanische stimuli cellulaire signalen activeren
- Onderzoeker rapporteert belangrijke componenten van antivirale verdediging van honingbijen
- Opnieuw klonen van de eerste gekloonde hond die tot nu toe als succesvol werd beschouwd
- Verborgen leger:hoe zeesterren in aantal konden groeien om koraalriffen aan te vallen
- Nobelprijswinnende Japanse chemicus sterft op 85

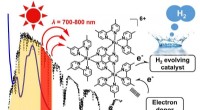
- NIR-gestuurde H2-evolutie uit water:uitbreidend golflengtebereik voor omzetting van zonne-energie
- Nieuwe batterij slokt kooldioxide op

- Biocompatibele fotonische kristallen breiden toepassingen uit van optica tot medicijnen
- Bestudeer polyfarmacologie eerder in medicijnontdekking, zeggen onderzoekers
 10 financiële tips voor voorbereiding op implementatie
10 financiële tips voor voorbereiding op implementatie  Wat gebeurt er onder de Yellowstone-vulkaan?
Wat gebeurt er onder de Yellowstone-vulkaan? Model voor op 2D materiaal gebaseerde RRAM gevonden
Model voor op 2D materiaal gebaseerde RRAM gevonden Eerste violen imiteerden menselijke stemmen:studie
Eerste violen imiteerden menselijke stemmen:studie NASA vindt overblijfselen van tropische cycloon Luban bij de grens met Jemen en Oman
NASA vindt overblijfselen van tropische cycloon Luban bij de grens met Jemen en Oman Botsende lasers verdubbelen de energie van protonenbundels
Botsende lasers verdubbelen de energie van protonenbundels Wie heeft steenkoolenergie ontdekt?
Wie heeft steenkoolenergie ontdekt?  Afbeelding:Licht van een ultracoole buurman
Afbeelding:Licht van een ultracoole buurman
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

