
Wetenschap
Enzym bleek de vorming van collageendragers te beheersen en de collageenafscheiding te remmen

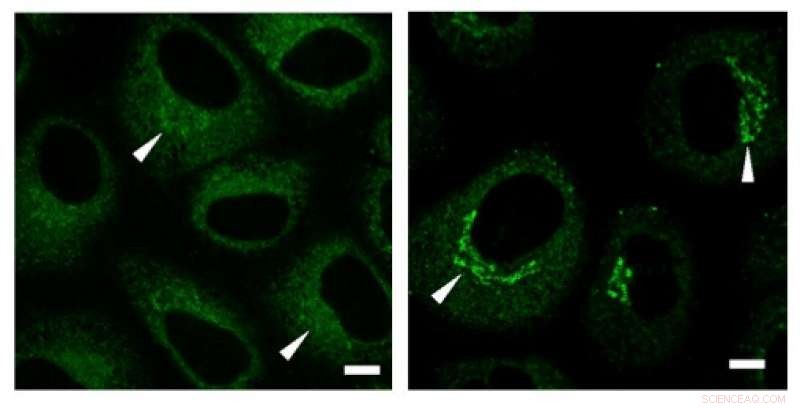
Elektronenmicroscopie toont de aanwezigheid van vele onderling verbonden blaasjes, die zich lijken te gedragen als collageendragers (aangegeven met pijlen). Credit: Biochemische en biofysische onderzoekscommunicatie
Onderzoekers van het Tokyo Institute of Technology (Tokyo Tech) hebben een enzym geïdentificeerd dat bepaalt hoeveel collageencellen afscheiden. Aangezien de onbalans in collageen verband houdt met een reeks menselijke ziekten, de studie geeft aanwijzingen voor nieuwe therapeutische strategieën. Bovendien, de bevindingen zouden een efficiënte productie van collageen voor het voedsel kunnen vergemakkelijken, cosmetische en farmaceutische industrie.
Alle cellen maken en geven eiwitten af. De eiwitten zijn als "lading" verpakt in kleine, belachtige blaasjes voordat ze buiten de cel worden getransporteerd. Dit proces, bekend als secretie, is essentieel voor een gezonde groei en ontwikkeling.
Hoewel veel studies hebben aangetoond hoe deze blaasjes, COPII-dragers genoemd, omgaan met relatief kleine vracht, weinigen hebben zich gericht op de werking van ongewoon grote dragers waarvan bekend is dat ze zeer grote eiwitten verpakken, zoals collageen.
Nutsvoorzieningen, een onderzoek door onder meer Masayuki Komada, Toshiaki Fukushima en afgestudeerde student Kohei Kawaguchi aan het Tokyo Institute of Technology hebben USP8 geïdentificeerd als een sleutelenzym dat betrokken is bij het beheersen van de vorming van grote collageendragers. Ze hebben hun bevindingen gerapporteerd in het tijdschrift Biochemische en biofysische onderzoekscommunicatie .
Het team toonde aan dat het "aanzetten" van USP8 de vorming van grote dragers remde, en dus verminderde collageenafscheiding. Omgekeerd, USP8 uitschakelen bevorderd collageentransport, wat leidde tot verhoogde collageenafscheiding. (Zie figuren 1-3.)
Immunokleuringsexperimenten onthulden een hoge concentratie collageen (groene signalen) in het Golgi-gebied voorafgaand aan secretie. Credit: Biochemische en biofysische onderzoekscommunicatie
De bevindingen hebben grote implicaties voor de geneeskunde en biotechnologie. Het is bekend dat overmatige collageenafscheiding in het menselijk lichaam orgaanfibrose veroorzaakt, terwijl te weinig collageenafscheiding wordt geassocieerd met botziekten, waaronder cranio-lenticulo-sutural dysplasie (CLSD) en Cole-Carpenter-syndroom. Nieuwe behandelingen voor deze ziekten kunnen worden ontwikkeld door een beter begrip van het exacte werkingsmechanisme van USP8. Dergelijke kennis zou ook nieuwe manieren kunnen bieden om de commerciële productie van collageen op te schalen.
De onderzoekers hebben aangetoond dat het enzym werkt door het deubiquitineren van een eiwit genaamd Sec31A, een onderdeel van de COPII-vesikelmantel die nodig is voor de export van eiwitten.
Een bepaalde groep eiwitten, het USP8-STAM1-complex genaamd, lijkt verantwoordelijk te zijn voor het deubiquitineren van Sec31A, zoals geïllustreerd in figuur 3.
Het onderzoek bouwt voort op jarenlang onderzoek dat de veelzijdigheid van USP8 heeft aangetoond.
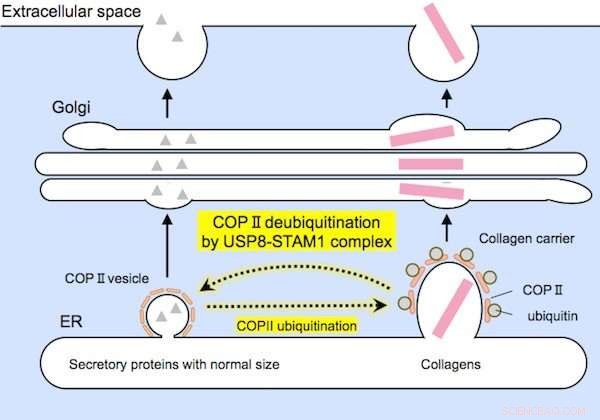
Relatief kleine eiwitten (aan de linkerkant) en grote collagenen (aan de rechterkant) worden voorafgaand aan secretie ingekapseld door COPII-dragers van geschikte afmetingen. Het USP8-STAM1-complex remt de vorming van grote collageendragers. Credit: Biochemische en biofysische onderzoekscommunicatie
"We hadden eerder gemeld dat USP8 de secretie van hypofysehormoon reguleert, " zegt Fukushima, verwijzend naar een artikel gepubliceerd in Natuurgenetica in 2015. "Tijdens dat onderzoek, we hebben per ongeluk ontdekt dat het USP8-STAM1-complex bindt aan Sec31."
Het was deze "toevallige" bevinding, gecombineerd met veelbelovende resultaten van andere groepen in de VS, dat bracht het team ertoe de rol van USP8 bij de vorming van COPII-dragers te onderzoeken.
In onderzoek dat meer dan een decennium teruggaat, Komada en anderen hebben de conventionele rol van USP8 bij de regulatie van endocytose verduidelijkt. "Het is heel interessant dat nu is aangetoond dat hetzelfde USP8-STAM1-complex een belangrijke rol speelt, zowel bij de regulatie van endocytose als bij de secretie, ', zegt Fukushima.
De huidige studie onthult daarom een "nieuw gezicht" van het USP8-enzym, en Fukushima laat doorschemeren dat er mogelijk nog meer verrassingen komen. USP8 behoort tot een familie van ongeveer 90 bekende deubiquitinerende enzymen, die nog steeds een hot topic zijn in de celbiologie.
 Nieuw composietmateriaal op basis van aluminium en samariumhexaboride met bijna nul uitzetting
Nieuw composietmateriaal op basis van aluminium en samariumhexaboride met bijna nul uitzetting Nieuw roodverschuivingsmechanisme van Ce3+ emissie in Ce
Nieuw roodverschuivingsmechanisme van Ce3+ emissie in Ce Milieuvriendelijk kooldioxide-conversieproces kan een revolutie teweegbrengen in de bestaande methode
Milieuvriendelijk kooldioxide-conversieproces kan een revolutie teweegbrengen in de bestaande methode Slim papier kan elektriciteit geleiden, water detecteren
Slim papier kan elektriciteit geleiden, water detecteren Raw Egg & Vinegar Experiments
Raw Egg & Vinegar Experiments
 Met geluid in de aarde kijken
Met geluid in de aarde kijken Gebouwd zand zuigt verontreinigende stoffen in het regenwater op
Gebouwd zand zuigt verontreinigende stoffen in het regenwater op Het redden van bossen in Amerika kan helpen de klimaatopwarming te beteugelen
Het redden van bossen in Amerika kan helpen de klimaatopwarming te beteugelen Tropical Storm Lane trekt weg van de eilanden van Hawaï
Tropical Storm Lane trekt weg van de eilanden van Hawaï Hoe droogte de watervoorziening in de hoofdsteden van Australië beïnvloedt
Hoe droogte de watervoorziening in de hoofdsteden van Australië beïnvloedt
Hoofdlijnen
- Vijf soorten genverbindingsmechanismen
- Hoe werken vaccins met het immuunsysteem?
- Onderzoek naar de levensstijl van microben
- Wetenschappers volgen aseksuele kleine wormen - waarvan de afstamming 18 miljoen jaar teruggaat
- Wat wordt er gebruikt om DNA op een specifieke locatie voor splitsing te knippen?
- Wat zijn lange ketens van aminozuren genaamd?
- Wat zou er gebeuren als een cel geen ribosomen had?
Cellen zijn de kleinste functionele eenheden van alle levende wezens. In de cellen bevinden zich gespecialiseerde structuren, organellen genaamd, die ze helpen bepaalde functies uit te voeren. Rib
- De voordelen en nadelen van het Bacillus-expressiesysteem
- Meiosis 2: Definition, Stages, Meiosis 1 vs Meiosis 2
- Kameleonmaterialen:de oorsprong van kleurvariatie in laagdimensionale perovskieten
- Nicotines houden vast:wat hebben de darmen en het geslacht ermee te maken?
- Superspoel mij! De kunst van geknoopt DNA-onderhoud

- Verhoogde bruikbaarheid en precisie bij vasculaire beeldvorming
- Nieuwe familie in de buurt:een nieuwe groep glycosidische enzymen
 Niveaus van celorganisatie
Niveaus van celorganisatie  Verschil tussen een coëfficiënt en een subscript
Verschil tussen een coëfficiënt en een subscript Superkritisch antwoord op afgewerkte olie gevonden
Superkritisch antwoord op afgewerkte olie gevonden China vertelt lokale meteorologische bureaus om smogwaarschuwingen te stoppen
China vertelt lokale meteorologische bureaus om smogwaarschuwingen te stoppen Toename van stormen kan catastrofale gevolgen hebben voor de visserijsector
Toename van stormen kan catastrofale gevolgen hebben voor de visserijsector Nieuwe studie onthult Europa's vroegste huismuis - snel gevolgd door de huiskat
Nieuwe studie onthult Europa's vroegste huismuis - snel gevolgd door de huiskat Superspons belooft effectieve giftige opruiming van meren en meer
Superspons belooft effectieve giftige opruiming van meren en meer Een drogere toekomst vormt het toneel voor meer bosbranden
Een drogere toekomst vormt het toneel voor meer bosbranden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

