
Wetenschap
Wat is een dubbele covalente binding en wat gebeurt daarin?
Overlapping van atomaire orbitalen:
De dubbele covalente binding ontstaat wanneer twee atomaire orbitalen van verschillende atomen elkaar aanzienlijk overlappen. Deze atomaire orbitalen moeten de juiste symmetrie en energieniveaus hebben om efficiënte overlap mogelijk te maken.
Elektronenkoppeling:
Elk atoom draagt twee elektronen bij die de overlappende atomaire orbitalen bezetten. Deze vier elektronen paren zich vervolgens en bezetten twee moleculaire orbitalen gevormd door de combinatie van de oorspronkelijke atomaire orbitalen.
Vorming van Sigma- en Pi-obligaties:
In een dubbele covalente binding vormt een van de elektronenparen een sigma (σ) binding, die wordt gevormd door de frontale overlap van atomaire orbitalen, wat resulteert in een sterke axiale binding tussen de twee atomen. Het andere elektronenpaar vormt een pi (π)-binding, die wordt gevormd door de zijwaartse overlap van atomaire orbitalen, waardoor een zwakkere binding boven en onder de sigma-binding ontstaat.
Elektronendelokalisatie:
De elektronen in een dubbele covalente binding zijn gedelokaliseerd, wat betekent dat ze niet beperkt zijn tot een specifiek gebied tussen de twee atomen. In plaats daarvan zijn ze verspreid, waardoor een elektronenwolk ontstaat die beide atomen omvat.
Bandsterkte:
Een dubbele covalente binding is sterker dan een enkele covalente binding omdat er vier elektronen worden gedeeld in plaats van twee. De grotere elektronendichtheid tussen de atomen leidt tot een grotere bindingssterkte en stabiliteit.
Voorbeelden van dubbele covalente obligaties:
Enkele veel voorkomende voorbeelden van moleculen met dubbele covalente bindingen zijn:
Ethyleen (C2H4):Elk koolstofatoom draagt twee elektronen bij om een dubbele covalente binding tussen de twee koolstofatomen te vormen.
Kooldioxide (CO2):Elk zuurstofatoom draagt twee elektronen bij om dubbele covalente bindingen te vormen met het centrale koolstofatoom.
Etheen (C2H4):Elk koolstofatoom deelt twee elektronen in een dubbele covalente binding, waardoor een dubbele koolstof-koolstofbinding ontstaat.
Implicaties in moleculaire structuur en eigenschappen:
De aanwezigheid van dubbele covalente bindingen heeft een aanzienlijke invloed op de moleculaire structuur en eigenschappen van verbindingen. Dubbele bindingen omvatten doorgaans kortere bindingslengtes, grotere bindingssterkte en beperkte rotatie rond de bindingsas in vergelijking met enkele bindingen. Deze factoren dragen bij aan de algehele stabiliteit, geometrie en reactiviteit van moleculen die dubbele covalente bindingen bevatten.
Over het geheel genomen is een dubbele covalente binding een cruciaal concept in de chemie, omdat het het delen van vier elektronen tussen twee atomen verklaart, wat leidt tot sterkere bindingen en de eigenschappen en het gedrag van verschillende moleculen beïnvloedt.
 Om de biosfeerwetenschap te versnellen, zeggen onderzoekers dat we drie wetenschappelijke culturen opnieuw met elkaar moeten verbinden
Om de biosfeerwetenschap te versnellen, zeggen onderzoekers dat we drie wetenschappelijke culturen opnieuw met elkaar moeten verbinden  Afbeelding:Halloween-scheur in de Brunt-ijsplaat
Afbeelding:Halloween-scheur in de Brunt-ijsplaat Vraag en antwoord:impact van inspanningen om ontbossing in Amazone te verminderen overschat, studie vondsten
Vraag en antwoord:impact van inspanningen om ontbossing in Amazone te verminderen overschat, studie vondsten Waar zullen grizzlyberen rondzwerven?
Waar zullen grizzlyberen rondzwerven?  Visserijlengte, inspanning van de visser:hoe ze zich verhouden
Visserijlengte, inspanning van de visser:hoe ze zich verhouden
Hoofdlijnen
- Reikwijdte van de basisterminologieën van de menselijke anatomie en fysiologie?
- Hoe een ‘kwal’-vormige structuur de druk in je cellen verlicht
- Waarom vallen orka’s bruinvissen lastig en doden ze ze zonder ze op te eten?
- DNA-replicatie vergelijken en contrasteren in prokaryoten en eukaryoten
- Typen agarplaten
- Wat voor soort voortplanting kun je afleiden uit een populatie van identieke individuen?
- Wat viel je op bij het construeren van het DNA-molecuul over de oriëntatie van twee strengen?
- Biologen werpen licht op hoe cellen hulpbronnen verplaatsen
- Weten apen wanneer ze moeten 'googlen'?
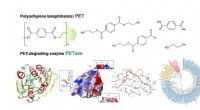
- Structureel inzicht in het moleculaire mechanisme van PET-degradatie
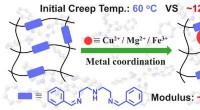
- Metaalcoördinatie maakt hoge temperatuur, kruipvast polyimine vitrimeer preparaat
- Nieuwe software brengt cryo-EM-kaarten met een lagere resolutie in beeld

- Wetenschappers beschrijven de structuur van een toekomstige luminescentiestof

- Chemici brengen een kunstmatige moleculaire zelfassemblage in kaart met de complexiteit van het leven
 Japan vertraagt landing van Hayabusa2-sonde op asteroïde:officieel
Japan vertraagt landing van Hayabusa2-sonde op asteroïde:officieel Restanten van een mega-overstroming op Mars
Restanten van een mega-overstroming op Mars Onderzoekers ontdekken ferro-elektriciteit op atomaire schaal
Onderzoekers ontdekken ferro-elektriciteit op atomaire schaal Grafeen kan een revolutie teweegbrengen in het internet der dingen
Grafeen kan een revolutie teweegbrengen in het internet der dingen Gericht op een nieuwe induceerbare isovorm voor de behandeling van metabole gerelateerde leververvetting
Gericht op een nieuwe induceerbare isovorm voor de behandeling van metabole gerelateerde leververvetting Storm Gloria eist 12 levens in Spanje, vier ontbrekende
Storm Gloria eist 12 levens in Spanje, vier ontbrekende Hoe een DC-generator te bouwen
Hoe een DC-generator te bouwen  Wat zijn kernwapens met een laag rendement?
Wat zijn kernwapens met een laag rendement?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

