
Wetenschap
Wat is de pka van een carbonzuur?
Voor een carbonzuur wordt de Ka gegeven door de volgende vergelijking:
$$Ka =\frac{[H3O+][A-]}{[HA]}$$
waarbij [H3O+] de concentratie hydroniumionen is, [A-] de concentratie van het carboxylaatanion is en [HA] de concentratie van het carbonzuur is.
De pKa van een carbonzuur kan op verschillende manieren worden geschat, waaronder:
* De Hammett-vergelijking: De Hammett-vergelijking is een lineaire vrije energierelatie die de pKa van een carbonzuur relateert aan de substituenten op het molecuul. De vergelijking wordt gegeven door:
$$pKa =pKa^0 + \som \sigma_i$$
waarbij pKa ^ 0 de pKa is van het ongesubstitueerde carbonzuur, en σi de Hammett-constanten zijn voor de substituenten op het molecuul.
* De Taft-vergelijking: De Taft-vergelijking is een andere lineaire vrije-energierelatie die de pKa van een carbonzuur relateert aan de inductieve en sterische effecten van de substituenten op het molecuul. De vergelijking wordt gegeven door:
$$pKa =pKa^0 + \rho^*\sigma^*_I + \delta\sigma^*_R$$
waarbij pKa ^ 0 de pKa is van het ongesubstitueerde carbonzuur, ρ* de inductieve parameter van Taft is, σ*I de inductieve constante van Taft is, δ de sterische parameter van Taft is en σ*R de sterische constante van Taft is.
* De Perrin-vergelijking: De Perrin-vergelijking is een complexere vergelijking die rekening houdt met de effecten van zowel inductieve als resonantie-effecten van de substituenten op het molecuul. De vergelijking wordt gegeven door:
$$pKa =pKa^0 + \som \sigma_i + \som \pi_i$$
waarbij pKa ^ 0 de pKa is van het ongesubstitueerde carbonzuur, zijn σi de Hammett-constanten voor de substituenten op het molecuul, en πi zijn de resonantieconstanten voor de substituenten op het molecuul.
De pKa van een carbonzuur is een belangrijke eigenschap die de reactiviteit ervan beïnvloedt. Carbonzuren met lage pKa-waarden zijn zuurder en reactiever dan carbonzuren met hoge pKa-waarden.
 Antilichaam-biosensor biedt onbeperkte medicatiebewaking op het punt van zorg
Antilichaam-biosensor biedt onbeperkte medicatiebewaking op het punt van zorg Wetenschappers laten zien dat er niets saai is aan het zien drogen van verf
Wetenschappers laten zien dat er niets saai is aan het zien drogen van verf  Verschillen tussen petroleumether en diethylether
Verschillen tussen petroleumether en diethylether  Wetenschappers ontwerpen organische kathode voor hoogwaardige batterijen
Wetenschappers ontwerpen organische kathode voor hoogwaardige batterijen Lang gezochte structuur van telomerase effent de weg voor nieuwe geneesmiddelen voor veroudering, kanker
Lang gezochte structuur van telomerase effent de weg voor nieuwe geneesmiddelen voor veroudering, kanker
 Wetenschappers wenden zich tot deep learning om de voorspellingen van de luchtkwaliteit te verbeteren
Wetenschappers wenden zich tot deep learning om de voorspellingen van de luchtkwaliteit te verbeteren Hoe beïnvloeden oceaan- en windstromen weer en klimaat?
Hoe beïnvloeden oceaan- en windstromen weer en klimaat?  Worst-case scenario's voor opwarming van de aarde niet geloofwaardig:studie
Worst-case scenario's voor opwarming van de aarde niet geloofwaardig:studie Hoge kooldioxide kan krimpende stengels in moerassen creëren
Hoge kooldioxide kan krimpende stengels in moerassen creëren Pitt-onderzoekers rapporteren push voor regionale groene infrastructuurdatabase
Pitt-onderzoekers rapporteren push voor regionale groene infrastructuurdatabase
Hoofdlijnen
- Bonobo's en chimpansees:wat onze naaste familieleden ons over mensen vertellen
- Deoxygenatie van de oceaan:een stille aanjager van de ondergang van koraalriffen?
- Door klimaat beïnvloede veranderingen in bloei, vruchtvorming heeft ook invloed op de vogelstand, activiteiten
- Geowetenschappers vergelijken micro-organismen in de poolgebieden
- Pesticiden kunnen ervoor zorgen dat hommels hun buzz verliezen, studie vondsten
- Onderzoek toont verschillen in energieverteerbaarheid tussen zeugen en gelten
- In de mangoestenmaatschappij immigranten zijn een bonus - als ze tijd krijgen om zich te vestigen
- Wil een mutatie de evolutie beïnvloeden, dan moet deze plaatsvinden in?
- Ontdekking van nieuwe soorten microfossielen kan eeuwenoude wetenschappelijke vragen beantwoorden
- Hoe de topologie van een poreus materiaal de fasescheiding van binaire mengsels beïnvloedt

- Surrey bouwt AI om chemische verbindingen tegen veroudering te vinden

- Samenstelling van wijnstokken in het regenwoud verhongert alvleesklierkankercellen
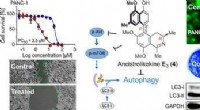
- Defecten aan het oppervlak van katalysatoren bepalen hun activiteit

- Unieke medicijnstructuren vinden met kunstmatige intelligentie en chemie

 Hoe de schokveer te bepalen
Hoe de schokveer te bepalen  Gezichtsherkenning verboden:wat is de volgende stap in Oakland, bij Amazon en meer
Gezichtsherkenning verboden:wat is de volgende stap in Oakland, bij Amazon en meer Je politieke opvattingen kunnen voorspellen hoe je bepaalde woorden uitspreekt
Je politieke opvattingen kunnen voorspellen hoe je bepaalde woorden uitspreekt  Manieren om een storm met luchtdruk voor te voorspellen
Manieren om een storm met luchtdruk voor te voorspellen  Wat als er zich een zwart gat zou vormen in de buurt van ons zonnestelsel?
Wat als er zich een zwart gat zou vormen in de buurt van ons zonnestelsel?  Hoe decimalen van minimaal naar Greatest
Hoe decimalen van minimaal naar Greatest Wat gebeurt er met een plantencel in een zoutoplossing?
Wat gebeurt er met een plantencel in een zoutoplossing?  Curiosity test een nieuwe manier om op Mars te boren
Curiosity test een nieuwe manier om op Mars te boren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

