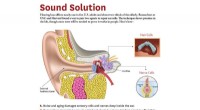
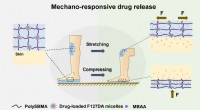
Wetenschap
Wat is de vuistregel voor het bepalen van het aantal covalente bindingen dat een atoom kan uitvoeren?
De vuistregel voor het bepalen van het aantal covalente bindingen dat een atoom kan uitvoeren, is door te kijken naar het aantal valentie-elektronen dat het atoom heeft. Valentie-elektronen zijn de elektronen in de buitenste schil van een atoom, en zij zijn de elektronen die deelnemen aan chemische bindingen. Het aantal covalente bindingen dat een atoom kan vormen is meestal gelijk aan het aantal valentie-elektronen dat het heeft. Koolstof heeft bijvoorbeeld vier valentie-elektronen, zodat het vier covalente bindingen kan vormen. Stikstof heeft vijf valentie-elektronen en kan dus vijf covalente bindingen vormen. Zuurstof heeft zes valentie-elektronen en kan dus zes covalente bindingen vormen.
Er zijn enkele uitzonderingen op deze vuistregel. Waterstof kan bijvoorbeeld slechts één covalente binding vormen, ook al heeft het één valentie-elektron. Dit komt omdat waterstof slechts één elektronenschil heeft en het elektron in deze schil met geen enkel ander atoom wordt gedeeld. Bovendien kunnen sommige atomen meer covalente bindingen vormen dan ze valentie-elektronen hebben door hun d-orbitalen te gebruiken. Dit wordt ‘hybridisatie’ genoemd. Koolstof kan bijvoorbeeld vier covalente bindingen vormen met behulp van zijn vier valentie-elektronen, maar het kan ook vijf covalente bindingen vormen door zijn d-orbitalen te gebruiken.
 Bepalen waarom het noordpoolgebied steeds groener wordt
Bepalen waarom het noordpoolgebied steeds groener wordt Met de hand droge toiletten bouwen in de kustdorpen van Papoea-Nieuw-Guinea om de gevolgen van klimaatverandering tegen te gaan
Met de hand droge toiletten bouwen in de kustdorpen van Papoea-Nieuw-Guinea om de gevolgen van klimaatverandering tegen te gaan China lanceert 's werelds eerste raket-ingezette weerinstrumenten van onbemand half-afzinkbaar voertuig
China lanceert 's werelds eerste raket-ingezette weerinstrumenten van onbemand half-afzinkbaar voertuig Zwitserse wacht op grote hoogte voor verloren gletsjer
Zwitserse wacht op grote hoogte voor verloren gletsjer Onderzoekers dichter bij bijna realtime rampenmonitoring
Onderzoekers dichter bij bijna realtime rampenmonitoring
Hoofdlijnen
- Hoe transhumanisme werkt
- Onderzoekers hebben voor het eerst de scharniermorfologie van het klinkmechanisme van de klikkever aangetoond
- Hoe voorspelbaar is evolutie?
- Heeft een videogame hiv genezen?
- Welke soorten cellen en organismen ondergaan mitose en meiose?
- Kunnen darmbacteriën de volgende sportdrank worden?
- Wie gebruikt de microscoop?
- Wat is de plaats van ademhaling bij bacteriën?
- Hoe celprocessen beschadigde eiwitten verzamelen en dumpen
 Zijn we bezig met politieke participatie via een gepersonaliseerd, on-demand tv-dieet?
Zijn we bezig met politieke participatie via een gepersonaliseerd, on-demand tv-dieet?  Welk type reactie is calciumhydroxide plus salpeterzuur?
Welk type reactie is calciumhydroxide plus salpeterzuur?  Vloeiend houden:onderzoeken hoe vloeistoffen zich gedragen bij gewichtloosheid
Vloeiend houden:onderzoeken hoe vloeistoffen zich gedragen bij gewichtloosheid Waarom vertoont ijzer 3 valentie?
Waarom vertoont ijzer 3 valentie?  Uit onderzoek blijkt hoe een graankorrel naakt werd en maïs koning werd
Uit onderzoek blijkt hoe een graankorrel naakt werd en maïs koning werd  Een hart van goud:beter weefselherstel na een hartaanval (update)
Een hart van goud:beter weefselherstel na een hartaanval (update) DNA-onderzoek van luipaarden in Zuid-Afrika traceert voorouders tot aan de ijstijd – en zal richting geven aan natuurbehoud
DNA-onderzoek van luipaarden in Zuid-Afrika traceert voorouders tot aan de ijstijd – en zal richting geven aan natuurbehoud  Bedreiging voor Florida neemt af, aangezien Isaias naar verwachting een tropische storm zal blijven
Bedreiging voor Florida neemt af, aangezien Isaias naar verwachting een tropische storm zal blijven
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com