
Wetenschap
Wat is het kookpunt van 1 molaire ureumoplossing?
De kookpuntverhoging van een oplossing wordt gegeven door de vergelijking:
$$\Delta T_b =K_b \cdot m$$
waarbij $\Delta T_b$ de kookpuntverhoging is, $K_b$ de kookpuntverhogingsconstante van het oplosmiddel is, en $m$ de molaliteit van de oplossing is.
Voor water is $K_b$ 0,512 °C/m. De molaliteit van een 1 molaire ureumoplossing is:
$$m =\frac{1 \text{ mol ureum}}{1 \text{ kg water}} =1 \text{ mol/kg}$$
Daarom is de kookpuntverhoging van een 1 molaire ureumoplossing:
$$\Delta T_b =0,512 °C/m \cdot 1 \text{ mol/kg} =0,512 °C$$
Het kookpunt van een 1 molaire ureumoplossing is daarom:
$$T_b =100 °C + 0,512 °C =100,512 °C$$
 Onderzoek naar vouwstabiliteit en dynamiek van eiwitten
Onderzoek naar vouwstabiliteit en dynamiek van eiwitten Welk molecuul is butyn?
Welk molecuul is butyn?  Wat gebeurt er als je een bariumchloride-oplossing combineert met een natriumsulfaatoplossing?
Wat gebeurt er als je een bariumchloride-oplossing combineert met een natriumsulfaatoplossing?  Vliegas-geopolymeerbeton:aanzienlijk verbeterde weerstand tegen extreme alkalische aanvallen
Vliegas-geopolymeerbeton:aanzienlijk verbeterde weerstand tegen extreme alkalische aanvallen Welk type binding als elektronen in een matrix van positief geladen atomen?
Welk type binding als elektronen in een matrix van positief geladen atomen?
Hoofdlijnen
- Waarom hebben plantencellen zowel celwanden als celmembranen?
- Waar in een eukaryote cel vindt anaërobe ademhaling plaats?
- Hebben genetische verbanden met moderne ziekten eeuwenoude voordelen opgeleverd?
- Slechte zaden:hoe de ouderlijke afstamming de levensvatbaarheid van tomatenhybriden kan bepalen
- Wat betekent ##### in Excel?
- Parasitaire mieren veranderen de manier waarop gevangenen nestgenoten herkennen
- Zes recente ontdekkingen die onze manier van denken over de menselijke oorsprong hebben veranderd
- Wat is een virus en hoe wordt het een gevaar voor het menselijk leven?
- Inspanningen zijn bedoeld om de verspreiding van vuurmieren in de VS te beperken
- Bruine koolstof van aromatische verontreinigende stoffen wordt uitgestoten tijdens verbranding en bosbranden
- Katalysatoren gevonden om koolstofdioxide om te zetten in brandstof

- Gemanipuleerde bacteriën produceren biomarkers voor kanker
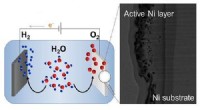
- Water splitsen voor de prijs van een nikkel
- 3D-afbeeldingen van stoffen sandwich kunnen helpen bij het meten van textielwrijving

 Een algenfoto-enzym dat blauw licht gebruikt om vetzuren om te zetten in koolwaterstoffen
Een algenfoto-enzym dat blauw licht gebruikt om vetzuren om te zetten in koolwaterstoffen Magnitude 6.9 aardbeving slaat toe voor de kust van Alaska
Magnitude 6.9 aardbeving slaat toe voor de kust van Alaska Afbeelding:Obscured Sirius onthult Gaia 1-cluster
Afbeelding:Obscured Sirius onthult Gaia 1-cluster Wat is de hybridisatie van BO33?
Wat is de hybridisatie van BO33?  Belast ons meer, Amerikaanse miljardairs zeggen:
Belast ons meer, Amerikaanse miljardairs zeggen: Team maakt drievoudige kankerbestrijdende polymeercapsules voor begeleide medicijntoediening
Team maakt drievoudige kankerbestrijdende polymeercapsules voor begeleide medicijntoediening Wetenschappers gebruiken druk om doorbraak van vloeibaar magnetisme te bewerkstelligen
Wetenschappers gebruiken druk om doorbraak van vloeibaar magnetisme te bewerkstelligen Kleine belletjes kunnen geheimen van immuuncellen onthullen en behandelingen verbeteren
Kleine belletjes kunnen geheimen van immuuncellen onthullen en behandelingen verbeteren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

