
Wetenschap
Wat zijn de antwoorden op paragraaf 6.1 Ionische binding?
Meerkeuzevragen:
1. Welke van de volgende elementen vormen gemakkelijk negatieve ionen?
a) Kalium
b) Chloor
c) Argon
d) Calcium
Antwoord:b) Chloor
2. Welk type binding ontstaat wanneer natrium- en chlooratomen worden gecombineerd?
a) Covalente binding
b) Waterstofbinding
c) Ionische binding
d) Metaalbinding
Antwoord:c) Ionische binding
3. Welk deeltje heeft een negatieve lading in een ionische verbinding?
a) Proton
b) Neutronen
c) Elektron
d) Kern
Antwoord:c) Elektron
4. Welke van de volgende verbindingen bevat een ionische binding?
a) Kooldioxide (CO2)
b) Calciumchloride (CaCl2)
c) Water (H2O)
d) Methaan (CH4)
Antwoord:b) Calciumchloride (CaCl2)
5. Ionische binding treedt op als gevolg van:
a) Het delen van elektronen tussen atomen
b) Overdracht van elektronen tussen atomen
c) Aanwezigheid van polaire covalente bindingen
d) Vorming van waterstofbruggen
Antwoord:b) Overdracht van elektronen tussen atomen
Vragen met een kort antwoord:
1. Noem twee elementen die gewoonlijk ionische bindingen met elkaar vormen.
Antwoord: Natrium en chloor, kalium en fluor.
2. Beschrijf het proces van elektronenoverdracht tijdens ionische binding.
Antwoord: Bij ionische binding brengt één atoom een of meer elektronen over naar een ander atoom, wat resulteert in de vorming van positief en negatief geladen ionen.
3. Leg uit waarom verbindingen met ionische bindingen hoge smelt- en kookpunten hebben.
Antwoord: De elektrostatische interacties tussen de tegengesteld geladen ionen in ionische verbindingen zijn zeer sterk en vereisen een aanzienlijke hoeveelheid energie om te overwinnen. Daarom hebben ionische verbindingen doorgaans hoge smelt- en kookpunten.
4. Geef een voorbeeld van een ionische verbinding en vermeld de daarin aanwezige ionen.
Antwoord: Een voorbeeld van een ionische verbinding is natriumchloride (NaCl). De ionen in natriumchloride zijn natriumionen (Na+) en chloride-ionen (Cl-).
5. Wat zijn de eigenschappen van ionische verbindingen?
Antwoord: Ionische verbindingen zijn doorgaans hard en bros, hebben hoge smelt- en kookpunten en zijn goede geleiders van elektriciteit in gesmolten of opgeloste toestand.
 Wetenschappers maken een atomair lijmpistool om betere nucleïnezuurtherapieën te bouwen
Wetenschappers maken een atomair lijmpistool om betere nucleïnezuurtherapieën te bouwen Onderzoekers produceren filamenten en vezels die drie keer fijner zijn dan een mensenhaar
Onderzoekers produceren filamenten en vezels die drie keer fijner zijn dan een mensenhaar Nieuw waterfiltratieproces gebruikt 1, 000 keer minder energie
Nieuw waterfiltratieproces gebruikt 1, 000 keer minder energie Hotel Ruthenium:hoe waterstof incheckt maar nooit weggaat
Hotel Ruthenium:hoe waterstof incheckt maar nooit weggaat Onderzoekers bepalen waarom gepulseerde vonken zorgen voor een betere ontsteking
Onderzoekers bepalen waarom gepulseerde vonken zorgen voor een betere ontsteking
 Honger, droogte, ziekte:VN-klimaatrapport onthult ernstige bedreigingen voor de gezondheid
Honger, droogte, ziekte:VN-klimaatrapport onthult ernstige bedreigingen voor de gezondheid Vliegtuigen gebruiken als weerstations
Vliegtuigen gebruiken als weerstations Nieuw onderzoek laat zien hoe meer boeren kunnen worden betrokken bij het ontwerpen van nieuw milieubeleid
Nieuw onderzoek laat zien hoe meer boeren kunnen worden betrokken bij het ontwerpen van nieuw milieubeleid  De toekomst van 1 miljard mensen in Zuid-Azië hangt af van het waterpact, zegt een nieuwe analyse
De toekomst van 1 miljard mensen in Zuid-Azië hangt af van het waterpact, zegt een nieuwe analyse  Brussel zet koers voor strijd om emissiereducties
Brussel zet koers voor strijd om emissiereducties
Hoofdlijnen
- Wat zijn waterhozen en hoe ontstaan ze?
- Een nieuwe route naar evolutie:hoe DNA van onze mitochondriën zich een weg baant in onze genomen
- Onderzoek onthult mechanismen achter de manier waarop groeiende cellen hun mojo behouden door de biosynthese op te schalen
- Wetenschappers hebben oude, bedreigde prikvissen gevonden in Queensland, 1400 km ten noorden van het eerder bekende verspreidingsgebied
- Hoe bijen leven met bacteriën
- Wilde vissen gedijen ondanks hopeloze monstermutaties, volgens onderzoek
- Hoe gelukkig te zijn in een relatie
- Klimaatverandering kan leiden tot intensere sprinkhanenuitbraken en een bedreiging vormen voor de voedselzekerheid
- Grafische Australische video van Japanse walvisvangst vrijgegeven
- Fasegescheiden eiwitachtige lijmen als zelforganizer van microfilamentnetwerken

- Onderzoekers rapporteren nieuwe oxyfluorideverbinding voor fotokatalyse
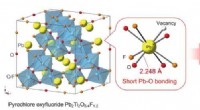
- Nieuwe connector voor duurzame constructies op aarde en in de ruimte

- Cranberry-oligosachariden kunnen urineweginfecties helpen voorkomen
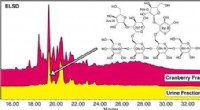
- Het beheersen van de nanoschaalstructuur van membranen is essentieel voor schoon water, onderzoekers vinden

 De huidige winter is een grote overwinning voor seizoensvoorspellingen
De huidige winter is een grote overwinning voor seizoensvoorspellingen Wetenschappers ontdekken een nieuwe staat van materie voor water
Wetenschappers ontdekken een nieuwe staat van materie voor water Onderzoekers voeren grootste supersonische turbulentiesimulatie ooit uit
Onderzoekers voeren grootste supersonische turbulentiesimulatie ooit uit Is er een manier om mijn zonnebril krasbestendig te maken?
Is er een manier om mijn zonnebril krasbestendig te maken?  De dennenbossen van Chili:een botanische dinosaurus die met uitsterven bedreigd is?
De dennenbossen van Chili:een botanische dinosaurus die met uitsterven bedreigd is?  Gevolgen van de microscoop op Science
Gevolgen van de microscoop op Science Een nieuwe kijk op hoe genen zich ontvouwen om hun expressie mogelijk te maken
Een nieuwe kijk op hoe genen zich ontvouwen om hun expressie mogelijk te maken  Veerkracht opbouwen in Vieques, Puerto Rico
Veerkracht opbouwen in Vieques, Puerto Rico
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

