
Wetenschap
De verhouding tussen een zuur en een base wordt bepaald door hoe volledig ze in water dissociëren?
De pH van een oplossing is een maatstaf voor de concentratie waterstofionen (H+) in de oplossing. Hoe lager de pH, hoe hoger de concentratie waterstofionen en hoe sterker het zuur. Hoe hoger de pH, hoe lager de concentratie waterstofionen en hoe sterker de base.
De pH-schaal loopt van 0 tot 14. Een pH-waarde van 7 is neutraal. Een pH lager dan 7 is zuur. Een pH boven de 7 is basisch.
De volgende tabel toont de pH-waarden van enkele veel voorkomende zuren en basen:
| Zuur | pH |
|---|---|
| Zoutzuur | 1 |
| Zwavelzuur | 1 |
| Salpeterzuur | 1 |
| Azijnzuur | 2.4 |
| Koolzuur | 3,8 |
| Basis | pH |
|---|---|
| Natriumhydroxide | 13 |
| Kaliumhydroxide | 13 |
| Calciumhydroxide | 12.4 |
| Magnesiumhydroxide | 10,5 |
| Ammoniak | 11.6 |
 Een nieuw chroomcomplex zendt licht uit in de ongrijpbare NIR-II-golflengte
Een nieuw chroomcomplex zendt licht uit in de ongrijpbare NIR-II-golflengte De verschillen tussen zout en suiker
De verschillen tussen zout en suiker  Welke invloed hebben temperatuur en druk op het ideale gas?
Welke invloed hebben temperatuur en druk op het ideale gas?  Een scanning transmissie-röntgenmicroscoop voor analyse van chemische toestanden van lithium
Een scanning transmissie-röntgenmicroscoop voor analyse van chemische toestanden van lithium Een moleculaire dans van fosfolipidesynthese
Een moleculaire dans van fosfolipidesynthese
 Sterke aardbeving schudt het Indonesische eiland Sulawesi door elkaar
Sterke aardbeving schudt het Indonesische eiland Sulawesi door elkaar Ongekende atlas van koraalriffen vrijgegeven
Ongekende atlas van koraalriffen vrijgegeven De hitte verslaan wordt steeds moeilijker, zegt de wetenschap
De hitte verslaan wordt steeds moeilijker, zegt de wetenschap UMD CONSERVE Centre leidt inspanningen om water- en voedselzekerheid te verbeteren
UMD CONSERVE Centre leidt inspanningen om water- en voedselzekerheid te verbeteren Wie zal de klimaatplannen van landen beoordelen?
Wie zal de klimaatplannen van landen beoordelen?
Hoofdlijnen
- Onderzoekers onderzoeken hoe virussen bacteriën vernietigen
- Wat heeft de vorm van een peer en heeft twee genomen? Controleer de vijver
- Wat maakt Francisella zo’n slechte acteur?
- Verschillen tussen gisten en vormpjes
- EU stelt stemming over verlenging omstreden vergunning voor onkruidverdelger uit
- Hoe genenbanken werken
- Ontdekking van jongens onthult zeer complexe interactie tussen plant en insect
- Dit is de reden waarom walvissen niet verdrinken als ze voedsel onder water opslokken
- Hoe belangrijk is de oceaan voor het fotosyntheseproces?
- Wetenschappers bedenken diervrije testen van dodelijke neurotoxines

- Nieuwe plastic biomaterialen kunnen leiden tot hardere, meer veelzijdige medische implantaten
- Ijzer- en zinktekorten aanpakken met beter brood

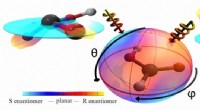
- Dupliceren of spiegelen? Laserlicht bepaalt chiraliteit van moleculen
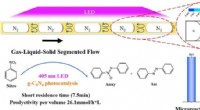
- Onderzoekers stellen een nieuwe benadering voor om heterogene fotosynthese van azoverbindingen te verbeteren
 Is Indy op jacht naar een nepperd?
Is Indy op jacht naar een nepperd?  Nederlandse politie traint adelaars om drones uit de lucht te vangen
Nederlandse politie traint adelaars om drones uit de lucht te vangen  Hoe de latitude en longtitude in feet te zetten
Hoe de latitude en longtitude in feet te zetten Griezelige bescherming:bedreigde diersoorten redden boven onze dode lichamen
Griezelige bescherming:bedreigde diersoorten redden boven onze dode lichamen Welke ionen zitten er in aluminiumhydroxide?
Welke ionen zitten er in aluminiumhydroxide?  Hoe lagers werken
Hoe lagers werken  Doorbraak in moleculaire elektronica maakt de weg vrij voor op DNA gebaseerde computercircuits in de toekomst
Doorbraak in moleculaire elektronica maakt de weg vrij voor op DNA gebaseerde computercircuits in de toekomst Instandhouding van erfgoed in Azië-Pacific profiteert van cultuurlandschapsbenadering
Instandhouding van erfgoed in Azië-Pacific profiteert van cultuurlandschapsbenadering
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

