
Wetenschap
Welke soorten ionische verbindingen zijn er?
1. Binaire ionische verbindingen:
- Deze verbindingen zijn samengesteld uit twee verschillende soorten ionen, één positief (kation) en één negatief (anion).
- Voorbeelden zijn natriumchloride (NaCl) en kaliumjodide (KI).
2. Polyatomaire ionische verbindingen:
- Deze verbindingen bevatten ten minste één polyatomair ion, een ion dat bestaat uit meerdere atomen die covalent aan elkaar zijn gebonden en een algehele lading dragen.
- Voorbeelden zijn ammoniumsulfaat ((NH4)2SO4) en natriumcarbonaat (Na2CO3).
3. Gehydrateerde ionische verbindingen:
- Deze verbindingen bevatten watermoleculen die aan de ionen zijn gehecht en vormen gehydrateerde ionen of coördinatiecomplexen.
- Voorbeelden hiervan zijn kopersulfaatpentahydraat (CuSO4·5H2O) en natriumthiosulfaatpentahydraat (Na2S2O3·5H2O).
4. Dubbele zouten:
- Deze verbindingen bevatten twee verschillende kationen of anionen gecombineerd in een enkel kristalrooster.
- Voorbeelden hiervan zijn kaliumnatriumtartraat (KNaC4H4O6·4H2O) en ammoniumferrosulfaat (NH4Fe(SO4)2·6H2O).
5. Basiszouten:
- Deze verbindingen bevatten zowel hydroxylionen (OH-) als andere anionen.
- Voorbeelden hiervan zijn koperhydroxidecarbonaat (Cu2(OH)2CO3) en magnesiumhydroxidechloride (Mg(OH)Cl).
6. Zure zouten:
- Deze verbindingen bevatten zowel waterstofionen (H+) als andere kationen.
- Voorbeelden zijn kaliumwaterstofsulfaat (KHSO4) en natriumwaterstofcarbonaat (NaHCO3).
7. Complexe zouten:
- Deze verbindingen bevatten een metaalion gebonden aan een complex ion, een polyatomisch ion met een centraal metaalatoom omgeven door liganden (meestal anionen of neutrale moleculen).
- Voorbeelden hiervan zijn kaliumhexacyanoferraat(III) (K3[Fe(CN)6]) en natriumnitroprusside (Na2[Fe(CN)5NO]·2H2O).
Dit zijn enkele veel voorkomende typen ionische verbindingen, maar er kunnen variaties en aanvullende classificaties zijn, afhankelijk van de specifieke eigenschappen en structuren van de verbindingen.
 Wat zit er in maïssiroop dat een bubbel maakt?
Wat zit er in maïssiroop dat een bubbel maakt?  Waarom tapdansen vervende gifkikkers?
Waarom tapdansen vervende gifkikkers?  Onderzoekers observeren een abnormaal stress-geheugeneffect dat stress-ontspanning in glas tegenhoudt
Onderzoekers observeren een abnormaal stress-geheugeneffect dat stress-ontspanning in glas tegenhoudt  Natuurkundigen ontwikkelen nieuw materiaal voor ontzilting van water
Natuurkundigen ontwikkelen nieuw materiaal voor ontzilting van water Welke term wordt gebruikt om de massa van 1 mol moleculen van een stof weer te geven?
Welke term wordt gebruikt om de massa van 1 mol moleculen van een stof weer te geven?
 ONS, EU-invoer van hardhout zorgt voor vernietiging Amazone:Greenpeace
ONS, EU-invoer van hardhout zorgt voor vernietiging Amazone:Greenpeace Wat zijn aardappelinsecten?
Wat zijn aardappelinsecten?  De wind sublimeert sneeuwvlokken op Antarctica
De wind sublimeert sneeuwvlokken op Antarctica Het plastic recyclingsysteem is kapot. Hier is hoe we het kunnen repareren
Het plastic recyclingsysteem is kapot. Hier is hoe we het kunnen repareren Politieke opvattingen hebben een beperkte invloed op hoe we klimaatafwijkingen waarnemen, studie vondsten
Politieke opvattingen hebben een beperkte invloed op hoe we klimaatafwijkingen waarnemen, studie vondsten
Hoofdlijnen
- Onderzoekers voeren een nieuwe analyse van het tarwemicrobioom uit onder vier managementstrategieën
- Wat gebeurt er in de interfase van de celcyclus?
- Waarom mensen schreeuwen,
- Wat gebeurt er met gentranscriptie tijdens DNA-schade?
- Wat exporteert en importeert materialen in de cel?
- Een vleugje 'liefdeshormoon' helpt apen een beetje vriendelijkheid te tonen
- Waarom haat Europa genetisch gemodificeerd voedsel en staat het op het punt van gedachten te veranderen?
- Hoe lokale ecologische kennis bedreigde en zeldzame dieren kan redden
- Bioloog legt uit waarom er dit jaar zoveel muggen waren
- Nieuwe verbinding kan voorkomen dat bacteriën ziekte veroorzaken

- Gegevensopslag met behulp van individuele moleculen

- Ontdekking kan microverontreinigingen uit het milieu verwijderen

- We begrijpen eindelijk hoe zuurstof reageert op platina
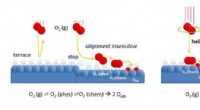
- Wetenschappers ontwikkelen een materiaal voor gebruik in stralingstolerante apparaten

 Zwaartekrachtgolven geven dosis realiteit over extra dimensies
Zwaartekrachtgolven geven dosis realiteit over extra dimensies Aanhoudende bacteriële uitbraak bij muggen beperkt de verspreiding van levensbedreigende ziekten
Aanhoudende bacteriële uitbraak bij muggen beperkt de verspreiding van levensbedreigende ziekten Bezorgd over klimaatverandering? Plant een overwinningstuin
Bezorgd over klimaatverandering? Plant een overwinningstuin Welk deel van de hersenen controleert emoties?
Welk deel van de hersenen controleert emoties?  Wat is oplosmiddel en opgeloste stof in zilver?
Wat is oplosmiddel en opgeloste stof in zilver?  Hoe Lucas Reagent te maken
Hoe Lucas Reagent te maken  Quantinuum-kwantumcomputer die de logische kwantumbits van Microsoft gebruikt, voert 14.000 experimenten uit zonder fouten
Quantinuum-kwantumcomputer die de logische kwantumbits van Microsoft gebruikt, voert 14.000 experimenten uit zonder fouten  Laatste onbekende structuur van HIV-1 opgelost, weer een stap in de strijd tegen het aids-virus
Laatste onbekende structuur van HIV-1 opgelost, weer een stap in de strijd tegen het aids-virus
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

