
Wetenschap
Waarom edelgassen de neiging hebben chemische bindingen te vormen?
Deze verbindingen worden vaak gevormd onder extreme omstandigheden, zoals hoge druk en temperatuur, of wanneer het edelgas zich in een zeer aangeslagen toestand bevindt. Hier zijn enkele voorbeelden van edelgasverbindingen:
- Xenontetrafluoride (XeF4):Deze verbinding wordt gevormd door de directe reactie van xenon en fluor onder hoge druk en temperatuur. Het is een kleurloos gas dat stabiel is bij kamertemperatuur.
- Kryptondifluoride (KrF2):Deze verbinding wordt gevormd door de reactie van krypton en fluor in een elektrische ontlading. Het is een kleurloos gas dat alleen stabiel is bij lage temperaturen.
- Radondifluoride (RnDF2):Deze verbinding wordt gevormd door de reactie van radon en fluor in een elektrische ontlading. Het is een kleurloos gas dat alleen stabiel is bij extreem lage temperaturen.
Edelgasverbindingen zijn over het algemeen zeer reactief en onstabiel. Ze vallen vaak gemakkelijk terug in hun samenstellende elementen. Dit komt omdat de bindingen tussen het edelgas en andere atomen relatief zwak zijn.
 Verzwakte Eta doordrenkt Honduras; zou de Golf van Mexico kunnen bereiken
Verzwakte Eta doordrenkt Honduras; zou de Golf van Mexico kunnen bereiken Hoe vulkanen exploderen in de diepzee
Hoe vulkanen exploderen in de diepzee Onderzoeken hoe Mei-yu-neerslag reageert op klimaatverandering
Onderzoeken hoe Mei-yu-neerslag reageert op klimaatverandering  Infrageluid van vulkaanuitbarsting onder water toont vorming van gigantische bellen
Infrageluid van vulkaanuitbarsting onder water toont vorming van gigantische bellen Gezondheidsrisico? Meer dan 500, 000 Amerikanen wonen binnen 3 mijl van aardgasfakkels
Gezondheidsrisico? Meer dan 500, 000 Amerikanen wonen binnen 3 mijl van aardgasfakkels
Hoofdlijnen
- De frisdrankmeren in Oost-Afrika stijgen en vormen een bedreiging voor hun iconische flamingo's
- Hoe reproduceren protisten?
- Bijenschadelijke pesticiden in 75 procent van de honing wereldwijd:studie
- Antibioticaresistentie:slapende bacteriën die medicamenteuze behandeling kunnen overleven geïdentificeerd
- Wat is het aantal chromosomen vóór mitose?
- Hoe kunnen mensen profiteren van de verschillende delen van een plant?
- Waarom is ATP nodig om het lichaam normaal te laten functioneren?
- Moet ik pompoentaart in de koelkast bewaren? Voedselveiligheidsinformatie voor het pompoenseizoen
- Wat zijn de suikertransporterende cellen in angiospermen?
- Glow-in-the-dark papier als sneltest voor infectieziekten

- Moleculaire schakelaar zal de ontwikkeling van baanbrekende elektro-optische apparaten vergemakkelijken

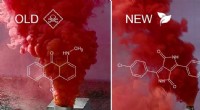
- Een groener alternatief voor roodgekleurde rook
- Hybride fotoactieve perovskieten voor het eerst gefotografeerd met atomaire resolutie

- Hoe maakten de oude meesters hun ultramarijn?
 Zonne capriolen
Zonne capriolen Terwijl Shatner naar de sterren gaat, visies van ruimte botsen
Terwijl Shatner naar de sterren gaat, visies van ruimte botsen Texanen geven verschillende factoren de schuld van de ernst van de winterstorm, hervormingspogingen ondersteunen
Texanen geven verschillende factoren de schuld van de ernst van de winterstorm, hervormingspogingen ondersteunen Hoe continenten werden gerecycled
Hoe continenten werden gerecycled Kunnen we de Neanderthalers terugbrengen?
Kunnen we de Neanderthalers terugbrengen?  Bloedzuigende insecten en insecten
Bloedzuigende insecten en insecten  Watersplitsingskatalysatoren ontwerpen met behulp van afvalgistbiomassa
Watersplitsingskatalysatoren ontwerpen met behulp van afvalgistbiomassa China haalt top 20 in Global Innovation Index
China haalt top 20 in Global Innovation Index
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

