
Wetenschap
Waarom is de metaalbinding in sommige metalen sterker dan die van andere metalen?
1. Aantal valentie-elektronen: Metalen met meer valentie-elektronen hebben doorgaans sterkere metaalbindingen. Dit komt omdat meer valentie-elektronen meer elektronen betekenen die kunnen worden gedelokaliseerd en gedeeld tussen de positief geladen metaalionen, waardoor de cohesie-energie en bindingssterkte toenemen. Aluminium heeft bijvoorbeeld drie valentie-elektronen en een relatief sterke metaalbinding, terwijl natrium slechts één valentie-elektron en een zwakkere metaalbinding heeft.
2. Atoomgrootte: Metalen met kleinere atoomstralen hebben doorgaans sterkere metaalbindingen. Dit komt omdat kleinere atomen dichter bij elkaar zijn gepakt, waardoor een betere overlap tussen hun elektronenorbitalen mogelijk is. De grotere overlap leidt tot een sterkere elektrostatische aantrekkingskracht en een stabielere metaalbinding. IJzer heeft bijvoorbeeld een kleinere atoomstraal en een sterkere metaalbinding dan lood.
3. Kristalstructuur: De kristalstructuur van een metaal heeft ook invloed op de sterkte van de metaalbinding. Metalen met een dicht opeengepakte kristalstructuur, zoals vlak-gecentreerd kubisch (FCC) of hexagonaal dicht opeengepakt (HCP), hebben sterkere metaalbindingen dan metalen met een lichaams-gecentreerd kubisch (BCC) of andere, minder dicht opeengepakte structuren. Dit komt omdat dicht opeengepakte structuren een efficiëntere pakking van atomen en een betere overlap tussen elektronenorbitalen mogelijk maken. Koper heeft bijvoorbeeld een FCC-structuur en een sterke metaalbinding, terwijl chroom een BCC-structuur en een zwakkere metaalbinding heeft.
4. Ionisch karakter: Sommige metalen vertonen een gedeeltelijk ionisch karakter in hun binding, wat de sterkte van de metaalbinding kan beïnvloeden. Wanneer het verschil in elektronegativiteit tussen de metaalatomen aanzienlijk is, kan de binding een ionisch karakter aannemen, waarbij het ene atoom fungeert als elektronendonor en het andere als elektronenacceptor. Dit ionische karakter kan de metaalbinding verzwakken, omdat het het aantal gedelokaliseerde elektronen vermindert en de elektrostatische afstoting tussen de positief geladen metaalionen vergroot. Calcium heeft bijvoorbeeld een licht ionische metaalbinding vanwege het verschil in elektronegativiteit tussen calcium en de omringende elektronen, waardoor de binding verzwakt in vergelijking met een puur metaalbinding.
Samenvattend wordt de sterkte van de metaalbinding in metalen bepaald door factoren zoals het aantal valentie-elektronen, atomaire grootte, kristalstructuur en ionisch karakter. Metalen met meer valentie-elektronen, kleinere atoomstralen, dicht opeengepakte kristalstructuren en een minimaal ionisch karakter hebben doorgaans sterkere metaalbindingen.
 Wat is de algemene vergelijking voor water en natriumcarbonaat?
Wat is de algemene vergelijking voor water en natriumcarbonaat?  Waterdamp verandert in vloeistof door?
Waterdamp verandert in vloeistof door?  Welke conclusie is gebaseerd op het goudfolie-experiment en het daaruit voortvloeiende atoommodel?
Welke conclusie is gebaseerd op het goudfolie-experiment en het daaruit voortvloeiende atoommodel?  Het nabootsen van het falen om de sterkte in composieten te vinden
Het nabootsen van het falen om de sterkte in composieten te vinden Van afval naar schat – Onderzoekers zetten metaalafval om in een katalysator voor waterstof
Van afval naar schat – Onderzoekers zetten metaalafval om in een katalysator voor waterstof
 Hoe hybride plantenvariëteiten de uitdagingen van voedselzekerheid en klimaatverandering kunnen aanpakken
Hoe hybride plantenvariëteiten de uitdagingen van voedselzekerheid en klimaatverandering kunnen aanpakken  Onderzoek naar ontbossing van narco's koppelt het verlies van tropische bossen in Midden-Amerika aan cocaïne
Onderzoek naar ontbossing van narco's koppelt het verlies van tropische bossen in Midden-Amerika aan cocaïne Welke gevolgen zal de klimaatverandering hebben voor kustgemeenschappen? Een onderzoek naar de barrière-eilanden van Virginia
Welke gevolgen zal de klimaatverandering hebben voor kustgemeenschappen? Een onderzoek naar de barrière-eilanden van Virginia  Dodelijke dieren die in het regenwoud leven
Dodelijke dieren die in het regenwoud leven Monitoring van kostbare grondwatervoorraden voor droge landbouwgebieden
Monitoring van kostbare grondwatervoorraden voor droge landbouwgebieden
Hoofdlijnen
- Computersimulaties onthullen wortels van resistentie tegen geneesmiddelen
- Hoe grotbiologie werkt
- Wetenschappers ontdekken een eeuwenoud geval van identiteitsverwisseling in de Chesapeake Bay
- Hoe vrouwelijke fruitvliegjes weten wanneer ze 'ja' moeten zeggen
- Hoe verschilt Cytokinese bij planten en dieren?
- Worden wetenschappers voor de gek gehouden door bacteriën?
- Hoe vleermuizen, wolven en motten ons leven kunnen vormen
- Biologie is wat, als milieu, wat?
- Alpaca's bleken het enige zoogdier te zijn dat rechtstreeks de baarmoeder insemineerde
- Wetenschappers ontwerpen nieuw responsief poreus materiaal geïnspireerd op eiwitten

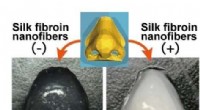
- Zijdevezels verbeteren bioinkt voor 3D-geprinte kunstmatige weefsels en organen
- Organisch ferromagnetisme:spins vangen in de glasachtige staat van een organische netwerkstructuur
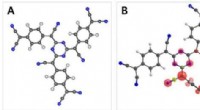
- Neutronen onderzoeken moleculair gedrag van voorgestelde COVID-19 kandidaat-geneesmiddelen
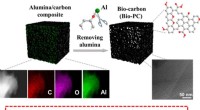
- Interfacial-geïnduceerde fabricage van poreuze koolstof met verbeterde intrinsieke actieve sites
 Onderzoekers ontdekken een sterke correlatie tussen partijdigheid en sociale mobiliteit tijdens de COVID-19-pandemie
Onderzoekers ontdekken een sterke correlatie tussen partijdigheid en sociale mobiliteit tijdens de COVID-19-pandemie Kankeropstoppingen:biomechanische factor bij geïdentificeerde maligniteiten
Kankeropstoppingen:biomechanische factor bij geïdentificeerde maligniteiten Onderzoek naar de duurzaamheid van de Indiase suikerindustrie
Onderzoek naar de duurzaamheid van de Indiase suikerindustrie Het klimaat van de staat China in 2020:weer warmer en natter
Het klimaat van de staat China in 2020:weer warmer en natter Mest kan je huis verwarmen
Mest kan je huis verwarmen Walmart gaat upscale met personal shopper service (Update)
Walmart gaat upscale met personal shopper service (Update) Een landmodel met laterale grondwaterstroming, waterverbruik, en bodem vries-dooi front dynamiek
Een landmodel met laterale grondwaterstroming, waterverbruik, en bodem vries-dooi front dynamiek Geowetenschappers bieden nieuw bewijs voor hoe het Adirondack-gebergte is gevormd
Geowetenschappers bieden nieuw bewijs voor hoe het Adirondack-gebergte is gevormd
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

