
Wetenschap
Wat is de bindingshoek en moleculaire vorm van siliciumdisulfide?
Deze moleculaire geometrie en bindingshoek kunnen worden begrepen op basis van de valentieschil-elektronenpaarafstotingstheorie (VSEPR). In SiS$_2$ is het centrale siliciumatoom (Si) gebonden aan twee zwavelatomen (S), elk via een dubbele binding. Silicium heeft vier valentie-elektronen, waarvan er twee betrokken zijn bij dubbele bindingen met elk zwavelatoom. Hierdoor blijven er twee vrije elektronenparen op het siliciumatoom achter.
Volgens de VSEPR-theorie zal de rangschikking van elektronenparen rond een centraal atoom een geometrie aannemen die de afstoting daartussen minimaliseert. In het geval van SiS$_2$ zijn de twee vrije elektronenparen op het siliciumatoom zo ver mogelijk uit elkaar georiënteerd om de elektron-elektronenafstoting te minimaliseren. Dit resulteert in de gebogen moleculaire geometrie met een bindingshoek van ongeveer 119,5 graden.
De hoekige of V-vormige moleculaire vorm van siliciumdisulfide wordt beïnvloed door de afstoting tussen de twee vrije elektronenparen op het siliciumatoom en de bindingsparen van elektronen die betrokken zijn bij de dubbele bindingen met de zwavelatomen. Deze opstelling leidt tot een vervormde tetraëdrische elektronenpaargeometrie rond het siliciumatoom, waardoor de gebogen moleculaire structuur ontstaat.
 Hoe neutraliseert de brandweer zuur?
Hoe neutraliseert de brandweer zuur?  Lijst met positieve en negatieve ionen
Lijst met positieve en negatieve ionen  Bij welk proces hieronder zijn geen metabole routes betrokken? A eiwitsynthese B oxidatie-reductie C ademhaling D fotosynthese E biosynthese?
Bij welk proces hieronder zijn geen metabole routes betrokken? A eiwitsynthese B oxidatie-reductie C ademhaling D fotosynthese E biosynthese?  Vaste kristallen die zichzelf assembleren om kanalen voor een elektrische stroom te vormen, kunnen veiligere batterijen maken
Vaste kristallen die zichzelf assembleren om kanalen voor een elektrische stroom te vormen, kunnen veiligere batterijen maken Lichtere voertuigen maken met magnesiumlegeringen
Lichtere voertuigen maken met magnesiumlegeringen
 Bosmeetsatelliet doorstaat tests met vlag en wimpel
Bosmeetsatelliet doorstaat tests met vlag en wimpel Wat de droogte in Kaapstad andere steden kan leren over klimaatadaptatie
Wat de droogte in Kaapstad andere steden kan leren over klimaatadaptatie Kleiner dan verwacht fytoplankton kan betekenen dat er minder koolstof wordt vastgelegd op de zeebodem
Kleiner dan verwacht fytoplankton kan betekenen dat er minder koolstof wordt vastgelegd op de zeebodem Twee dammen illustreren de uitdaging om oudere ontwerpen te behouden
Twee dammen illustreren de uitdaging om oudere ontwerpen te behouden Samenwerken of confronteren? Nieuw onderzoek levert belangrijke inzichten op voor milieu-NGO's
Samenwerken of confronteren? Nieuw onderzoek levert belangrijke inzichten op voor milieu-NGO's
Hoofdlijnen
- Wat is een vrijgesteld menselijk exemplaar?
- Het team van Rensselaer laat zien hoe je ruwe overheidsdata analyseert
- Is Rust Dust schadelijk?
- Nieuwe analyse laat zien hoe eiwitten overgaan naar de werkmodus
- Een dierencel maken voor een wetenschapsproject
- Hoe maak je een MRI van je draak:onderzoekers ontwikkelen de eerste hersenatlas van de baardagaam
- Wat is het verschil tussen citroenzuurmono en anhydrus?
- Wetenschappers ontdekken hoe de hersenen van de zangvogel de timing tijdens het zingen regelen
- Hoe virussen en bacteriën elkaar in evenwicht houden in het darmmicrobioom
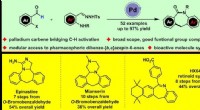
- Modulaire benadering van dibenzo-gefuseerde ε-lactams door middel van carbeen overbruggende CH-activering
- Wetenschappers ontwikkelen kunstmatig fotosyntheseapparaat voor groenere ethyleenproductie

- Kunstmatige antimicrobiële peptiden kunnen helpen om resistente bacteriën te overwinnen
- De bitumenpuzzel kraken

- Nieuw algoritme helpt vergeten figuren onder Da Vinci-schilderij te ontdekken

 Klopt de theorie over het klimaat op aarde in de afgelopen 15 miljoen jaar?
Klopt de theorie over het klimaat op aarde in de afgelopen 15 miljoen jaar? Hoe zal de aarde er over 5000 jaar uitzien?
Hoe zal de aarde er over 5000 jaar uitzien?  Hoe te bepalen of een Caterpillar man of vrouw is
Hoe te bepalen of een Caterpillar man of vrouw is Nobelprijsuitreikingen opnieuw ingekort vanwege pandemie
Nobelprijsuitreikingen opnieuw ingekort vanwege pandemie Een tijdlijn van miljardair Elon Musks bod om Twitter te controleren
Een tijdlijn van miljardair Elon Musks bod om Twitter te controleren Ultraschone steenkool – Zou de prijs nu de juiste kunnen zijn om de klimaatverandering te helpen bestrijden?
Ultraschone steenkool – Zou de prijs nu de juiste kunnen zijn om de klimaatverandering te helpen bestrijden?  Beschrijf het proces van elektrolyse bij de productie van metalen
Beschrijf het proces van elektrolyse bij de productie van metalen  Hoe kunnen leiders vertrouwen creëren als de informatie steeds verandert?
Hoe kunnen leiders vertrouwen creëren als de informatie steeds verandert?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

