
Wetenschap
Wat is het proces van neutralisatieproces?
Hier is een stapsgewijze uitleg van het neutralisatieproces:
1. Mengen van zuur en base:Wanneer een zuur en een base worden gemengd, dissociëren de moleculen van het zuur in water om H+-ionen vrij te maken, terwijl de moleculen van de base dissociëren om OH-ionen vrij te maken.
2. Ionische uitwisseling:De H+-ionen van het zuur en de OH-ionen van de base reageren met elkaar om watermoleculen (H2O) te vormen via een proces dat protonenoverdracht wordt genoemd. Deze reactie wordt weergegeven als:
H+ + OH- -> H2O
3. Zoutvorming:Terwijl de H+ en OH- ionen worden verbruikt bij de vorming van water, blijven de positief geladen ionen van de base (kationen) en de negatief geladen ionen van het zuur (anionen) in de oplossing. Deze ionen vormen samen een zout.
4. Voltooiing van de reactie:De neutralisatiereactie gaat door totdat alle H+-ionen van het zuur en alle OH-ionen van de base zijn verbruikt, wat resulteert in de volledige neutralisatie van het zuur en de base.
5. pH-waarde:De pH-waarde van de resulterende oplossing hangt af van de sterkte van het gebruikte zuur en de base. Als het zuur en de base sterk zijn, zal de pH dichtbij 7 liggen, wat wijst op een neutrale oplossing. Als het zuur of de base zwak is, kan de pH zuur of basisch zijn, afhankelijk van de relatieve sterkte van de reactanten.
Over het geheel genomen omvat het neutralisatieproces de reactie tussen H+-ionen en OH-ionen om water en een zout te vormen, wat leidt tot de vorming van een neutrale of licht zure of basische oplossing.
 Hoe worden ethaanbindingen gevormd met diagrammen?
Hoe worden ethaanbindingen gevormd met diagrammen?  Neutronenwetenschap verklaart het mysterie van hoe de antivrieseiwitten van Arctische vissen werken
Neutronenwetenschap verklaart het mysterie van hoe de antivrieseiwitten van Arctische vissen werken  Sinaasappelschilolie opzuigen tot nieuwe, aangename aromastoffen
Sinaasappelschilolie opzuigen tot nieuwe, aangename aromastoffen De deeltjesfasechemie zorgt ervoor dat roet beter wolken kan zaaien
De deeltjesfasechemie zorgt ervoor dat roet beter wolken kan zaaien Studie toont afstembaarheid van een moleculaire chaperonne aan
Studie toont afstembaarheid van een moleculaire chaperonne aan
Hoofdlijnen
- Welke soorten moleculen katalyseren RNA-splitsing?
- Zijn mitochondriën groter dan een nucleolus?
- Welke structuren worden aangetroffen in dierlijke cellen, maar niet in plantencellen?
- Hoe de microprocessor de miRNA-productie nauwkeurig initieert
- Waarom verandert de vorm van een rode bloedcel in verschillende oplossingen?
- Wat maakt sommige oesters veerkrachtiger dan andere?
- Onderzoekers ontdekken hoe weefsels en organen tijdens de embryogenese worden vormgegeven
- Geklede varkenskarkassen onthullen de geheimen van mummificatie; onderzoek biedt inzichten voor forensische wetenschappers
- Oedogonium Life Cycle
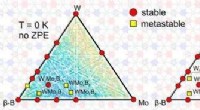
- Wetenschappers voorspellen nieuwe, moeilijk, en superharde ternaire verbindingen
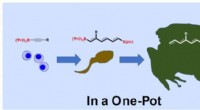
- Onderzoekers ontwikkelen chemische reactiemethode voor efficiëntere medicijnproductie
- Een concrete stap in de richting van nul CO2-uitstoot bij de cementproductie

- Licht werpen op een schimmige organisatorische hub in cellen
- Bacteriën gebruiken om een waterfilter te maken dat bacteriën doodt

 Hoe vaak komt ionische binding voor in het lichaam?
Hoe vaak komt ionische binding voor in het lichaam?  Hoe verhouden planten zich tot zonnecellen als het gaat om het verzamelen van energie?
Hoe verhouden planten zich tot zonnecellen als het gaat om het verzamelen van energie?  Welk kenmerk van het levende organisme amoebe of paramecium en spirogyra?
Welk kenmerk van het levende organisme amoebe of paramecium en spirogyra?  Machine learning voorspelt het gedrag van biologische circuits
Machine learning voorspelt het gedrag van biologische circuits Veldelektronenemitters van koolstofnanobuisjes krijgen ruimtetesten
Veldelektronenemitters van koolstofnanobuisjes krijgen ruimtetesten Weather Service heeft op het laatste moment besloten de sneeuwvoorspelling niet te verlagen
Weather Service heeft op het laatste moment besloten de sneeuwvoorspelling niet te verlagen Wat is de structuur van SO3 volgens de vespertheorie?
Wat is de structuur van SO3 volgens de vespertheorie?  Kwantuminformatie krijgt een boost door doorbraak in dunne films
Kwantuminformatie krijgt een boost door doorbraak in dunne films
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

