
Wetenschap
Waarom verspreiden twee gassen zich gemakkelijk door elkaar?
De dichtheid van een gas is ook een factor in hoe gemakkelijk het zich verspreidt. De dichtheid van een gas is de massa van het gas per volume-eenheid. Hoe lager de dichtheid van een gas, hoe gemakkelijker het zich zal verspreiden. Dit komt omdat hoe lichter de moleculen van een gas zijn, hoe gemakkelijker ze kunnen worden verplaatst door botsingen met andere moleculen.
De kinetische energie van een gas is ook een factor in hoe gemakkelijk het zich verspreidt. De kinetische energie van een gas is de bewegingsenergie van de gasdeeltjes. Hoe hoger de kinetische energie van een gas, hoe gemakkelijker het zich zal verspreiden. Dit komt omdat hoe sneller de moleculen van een gas bewegen, hoe groter de kans is dat ze in botsing komen met andere moleculen en van richting veranderen.
Samenvattend kunnen twee gassen zich gemakkelijk door elkaar verspreiden vanwege hun lage dichtheid en hoge kinetische energie. De deeltjes van een gas bevinden zich ver uit elkaar en bewegen snel, wat betekent dat ze regelmatig met elkaar en de wanden van hun container botsen. Deze constante beweging zorgt ervoor dat de gassen zich over een groot volume verspreiden.
 Radioactiviteit in delen van de Marshalleilanden is veel hoger dan in Tsjernobyl, studie zegt:
Radioactiviteit in delen van de Marshalleilanden is veel hoger dan in Tsjernobyl, studie zegt: Wetenschappers ontwikkelen nieuw landoppervlakmodel om de wereldwijde rivierwateromgeving te volgen
Wetenschappers ontwikkelen nieuw landoppervlakmodel om de wereldwijde rivierwateromgeving te volgen Concurrerende Colorado River-plannen laten zien dat zeven staten het niet eens kunnen worden over de manier waarop ze de kritieke watervoorziening moeten beheren
Concurrerende Colorado River-plannen laten zien dat zeven staten het niet eens kunnen worden over de manier waarop ze de kritieke watervoorziening moeten beheren  Koraalriffen schuiven weg van de evenaar
Koraalriffen schuiven weg van de evenaar Onderzoekers onthullen kosten van belangrijke klimaatoplossing
Onderzoekers onthullen kosten van belangrijke klimaatoplossing
Hoofdlijnen
- Wat is de oorsprong en betekenis van naam?
- De celstructuur van een ui
- Hoe rode bloedcellen hun kernen vernietigen
- Waarom husky’s blauwe ogen hebben
- Waar is mensenhaar van gemaakt?
- Ontdekking laat zien hoe cellen zichzelf verdedigen tijdens stressvolle situaties
- Eerste celkaart van 20, 000 cellen in zoogdierembryo
- Wat is een homoloog allel?
- Flagella: soorten, functie en structuur
- Ontwikkeling van fluoralkylcarbonaten om de farmaceutische en chemische industrie schoner en veiliger te maken

- Moleculair jodium katalyseert processen voor antivirale en farmaceutische syntheses
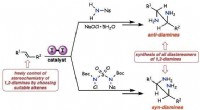
- Speeksel van wasworm bevat enzymen die plastic kunnen afbreken

- Moleculaire dynamische simulatie werpt nieuw licht op de vorming van methaanhydraat

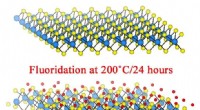
- Fluor stroomt naar binnen, maakt materiaal metaal
 Hittegolf en klimaatverandering hebben een negatieve invloed op onze bodem, zeggen experts
Hittegolf en klimaatverandering hebben een negatieve invloed op onze bodem, zeggen experts Amazon voegt gratis muziek toe voor iedereen, met advertenties
Amazon voegt gratis muziek toe voor iedereen, met advertenties Nieuwe computersimulatie helpt bij het zoeken naar de oorsprong van kosmische straling
Nieuwe computersimulatie helpt bij het zoeken naar de oorsprong van kosmische straling 8 delen van Science Fair-projecten
8 delen van Science Fair-projecten  Hong Kong-luchtvaartmaatschappij Cathay Pacific vraagt al het personeel onbetaald verlof op te nemen
Hong Kong-luchtvaartmaatschappij Cathay Pacific vraagt al het personeel onbetaald verlof op te nemen Vraag en antwoord:wat is bitcoin?
Vraag en antwoord:wat is bitcoin? Hoe elektriciteitsnetten werken
Hoe elektriciteitsnetten werken  Xiaomi:een Chinese startup die Google uitdaagt, Amazone
Xiaomi:een Chinese startup die Google uitdaagt, Amazone
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

