
Wetenschap
Waarom is h2so4 stroperig?
1. Waterstofbinding:H2SO4-moleculen vertonen een sterke intermoleculaire waterstofbinding tussen het waterstofatoom van de hydroxylgroep en het zuurstofatoom van de sulfaatgroep. Deze waterstofbruggen creëren een netwerk van interacties tussen moleculen, wat leidt tot een verhoogde weerstand tegen stroming en een hogere viscositeit.
2. Polariteit:H2SO4 is een polair molecuul, wat betekent dat het een gedeeltelijk positieve lading heeft op de waterstofatomen en een gedeeltelijk negatieve lading op de zuurstofatomen. Door de polaire aard van de moleculen kunnen ze met elkaar interageren door middel van elektrostatische krachten, waardoor de viscositeit verder wordt verbeterd.
3. Concentratie:De viscositeit van zwavelzuur hangt ook af van de concentratie. Geconcentreerd zwavelzuur heeft een hogere viscositeit vergeleken met verdund zwavelzuur. Naarmate de concentratie van H2SO4 toeneemt, neemt het aantal waterstofbruggen en de elektrostatische interacties tussen moleculen toe, waardoor de vloeistof stroperiger wordt.
4. Temperatuurafhankelijkheid:De viscositeit van zwavelzuur is omgekeerd evenredig met de temperatuur. Naarmate de temperatuur stijgt, neemt de kinetische energie van de moleculen toe, waardoor ze sneller bewegen en de intermoleculaire krachten overwinnen. Dit resulteert in een afname van de viscositeit bij toenemende temperatuur.
5. Opgeloste soorten:De aanwezigheid van opgeloste soorten, zoals metaalionen of andere onzuiverheden, kan ook de viscositeit van zwavelzuur beïnvloeden. Deze opgeloste soorten kunnen interageren met de zuurmoleculen, waardoor de sterkte en het aantal waterstofbruggen en elektrostatische interacties veranderen, waardoor de viscositeit wordt beïnvloed.
Over het geheel genomen draagt de combinatie van sterke waterstofbinding, polariteit, concentratie, temperatuurafhankelijkheid en opgeloste soorten bij aan de stroperige aard van zwavelzuur.
 Nieuw patent voor biobased polymeer voor gebruik in piëzo-elektrische apparaten
Nieuw patent voor biobased polymeer voor gebruik in piëzo-elektrische apparaten  Rangschik het volgende in oplopende volgorde van krachtaantrekking tussen deeltjes water, suiker en zuurstof?
Rangschik het volgende in oplopende volgorde van krachtaantrekking tussen deeltjes water, suiker en zuurstof?  Er wordt een resistenter materiaal tegen micro-organismen gecreëerd om cultureel erfgoed te herstellen
Er wordt een resistenter materiaal tegen micro-organismen gecreëerd om cultureel erfgoed te herstellen Welk zout krijg je door salpeterzuur en kaliumhydroxide te mengen?
Welk zout krijg je door salpeterzuur en kaliumhydroxide te mengen?  Heteractis magnifica zeeanemonen kunnen helpen bij het bestrijden van de ziekte van Alzheimer
Heteractis magnifica zeeanemonen kunnen helpen bij het bestrijden van de ziekte van Alzheimer
 Van gegevens tot beslissingen:AI en IoT voor het voorspellen van aardbevingen
Van gegevens tot beslissingen:AI en IoT voor het voorspellen van aardbevingen  Uit onderzoek blijkt waarom er klauwen naar voren komen bij het beheer van wilde katten
Uit onderzoek blijkt waarom er klauwen naar voren komen bij het beheer van wilde katten  Wat zijn de componenten van het vallei-ecosysteem?
Wat zijn de componenten van het vallei-ecosysteem?  Voedingsonderzoek onthult instabiliteit in 's werelds belangrijkste visserijregio's
Voedingsonderzoek onthult instabiliteit in 's werelds belangrijkste visserijregio's Hoe veranderingen in oude bodemmicroben de toekomst van het noordpoolgebied kunnen voorspellen
Hoe veranderingen in oude bodemmicroben de toekomst van het noordpoolgebied kunnen voorspellen
Hoofdlijnen
- Wat is het dominante fenotype?
- Waar kwamen de eerste suikers vandaan?
- Neanderthalers waren eigenlijk prehistorische Picasso's
- Het Paleozoïcum dieet:waarom dieren eten wat ze doen
- Studie:Hoe we omgaan met dieren werpt licht op de Amerikaanse sociale ongelijkheid
- Welke soorten organische moleculen vormen een celmembraan?
- Wat zijn chromatine en chromosomen?
- Kunnen katten en coyotes naast elkaar bestaan?
- Het verzamelen van levende slangen in afgelegen Amazonegebieden voor onderzoek is geen gemakkelijke taak; dit is hoe we dat doen
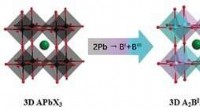
- Onderzoekers ontwikkelen halide dubbele perovskiet ferro-elektriciteit
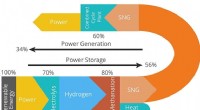
- Methaan kansrijke route voor opslag duurzame energie uit zon en wind
- Hoe zout uit water te halen:laat het zelf uitwerpen

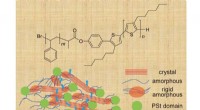
- Elektrische verbetering:ingenieurs versnellen elektronen in halfgeleiders
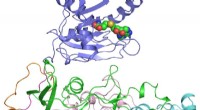
- Onderzoekers kraken de structuur van het belangrijkste eiwit in het Zika-virus
 EarthCARE-satelliet om te onderzoeken hoe wolken het klimaat beïnvloeden
EarthCARE-satelliet om te onderzoeken hoe wolken het klimaat beïnvloeden  Handscanner voor het detecteren van gevaarlijke stoffen en explosieven
Handscanner voor het detecteren van gevaarlijke stoffen en explosieven Wat gebeurt er als ferrosulfaatkristallen worden verwarmd en de chemische balansvergelijking wordt gegeven?
Wat gebeurt er als ferrosulfaatkristallen worden verwarmd en de chemische balansvergelijking wordt gegeven?  Boeketten nanobloemen met een gouden toets
Boeketten nanobloemen met een gouden toets Er ontstaan slimme laboratoria voor op maat gemaakte synthese van nanomaterialen
Er ontstaan slimme laboratoria voor op maat gemaakte synthese van nanomaterialen  Milieuvriendelijke productie van silicium nanodraden
Milieuvriendelijke productie van silicium nanodraden Klimaat somberheid en onheil? Laat maar komen. Maar we hebben verhalen nodig over actie ondernemen, te
Klimaat somberheid en onheil? Laat maar komen. Maar we hebben verhalen nodig over actie ondernemen, te Onbeleefdheid op het werk:wordt het 'koninginbijensyndroom' erger?
Onbeleefdheid op het werk:wordt het 'koninginbijensyndroom' erger?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

