
Wetenschap
Bij biologische toepassingen verdient het vaak de voorkeur om oplossingsconcentraties in molaliteit te meten in plaats van molariteit, vooral als oplossingen van twee verschillende stoffen worden vergeleken. Dit omdat?
Bij veel biologische toepassingen verdient het de voorkeur oplossingsconcentraties in molaliteit te meten in plaats van molariteit, vooral als oplossingen van twee verschillende stoffen worden vergeleken. Dit komt omdat de molaliteit rekening houdt met de massa van het oplosmiddel, die kan variëren afhankelijk van de concentratie opgeloste stof.
Als we bijvoorbeeld twee oplossingen hebben, één met 1 mol NaCl opgelost in 1 liter water en de andere met 1 mol glucose opgelost in 1 liter water, zullen de molariteiten van beide oplossingen hetzelfde zijn (1 M). De molaliteiten van de twee oplossingen zullen echter verschillend zijn, omdat de massa water die nodig is om 1 mol NaCl op te lossen anders is dan de massa water die nodig is om 1 mol glucose op te lossen.
Dit verschil in molaliteit kan belangrijk zijn bij biologische toepassingen, omdat het de eigenschappen van de oplossing kan beïnvloeden. De osmotische druk van een oplossing wordt bijvoorbeeld bepaald door de molaliteit van de oplossing, niet door de molariteit.
Daarom verdient het bij het vergelijken van oplossingen van verschillende stoffen vaak de voorkeur om molaliteit te gebruiken in plaats van molariteit, omdat molaliteit rekening houdt met de massa van het oplosmiddel en een nauwkeuriger weergave kan geven van de concentratie van de oplossing.
 Computermodel met hoge doorvoer voorspelt diffusiegegevens voor het transport van lichte elementen in vaste stoffen
Computermodel met hoge doorvoer voorspelt diffusiegegevens voor het transport van lichte elementen in vaste stoffen Wat is de functie van natriumdodecylsulfaat bij een DNA-extractie?
Wat is de functie van natriumdodecylsulfaat bij een DNA-extractie?  Nieuwe techniek opent nieuwe onderzoeksmogelijkheden voor nieuwe medicijnen en lekker eten
Nieuwe techniek opent nieuwe onderzoeksmogelijkheden voor nieuwe medicijnen en lekker eten Voedselkwaliteitscontrole sneller en gemakkelijker gemaakt
Voedselkwaliteitscontrole sneller en gemakkelijker gemaakt Waar reageert koolwaterstof mee als het wordt verbrand?
Waar reageert koolwaterstof mee als het wordt verbrand?
 De grillen van de natuur veroorzaken watercrises - groene infrastructuur kan ze stoppen
De grillen van de natuur veroorzaken watercrises - groene infrastructuur kan ze stoppen Opwarming van de oceaan om verhoogde CO2-gedreven productiviteit teniet te doen
Opwarming van de oceaan om verhoogde CO2-gedreven productiviteit teniet te doen Feiten over hagel, de ijzige neerslag die je vaak tegenkomt in de lente en de zomer
Feiten over hagel, de ijzige neerslag die je vaak tegenkomt in de lente en de zomer  Heeft hetero-opgroeien geëvolueerd van autotrofen?
Heeft hetero-opgroeien geëvolueerd van autotrofen?  Dieren die afhankelijk zijn van Tides for Survival
Dieren die afhankelijk zijn van Tides for Survival
Hoofdlijnen
- Hittegolf veroorzaakt valse herfst in het VK
- Maagdelijke geboorten door parthenogenese:hoe vrouwtjes sommige soorten zich kunnen voortplanten zonder mannetjes
- Gekruiste (evolutionaire) signalen?
- Community (ecologie): definitie, structuur, theorie en voorbeelden
- Waarom wordt micro-evolutie beweerd door creationisten en evolutiewetenschappers?
- Doen probiotica echt iets? | Hoe dingen werken
- Baanbrekende ontdekking van een geurdetecterende receptorversterker
- Hoe dieren hun juiste grootte bereiken
- Waarom zijn netwerken stabiel? Onderzoekers lossen een 50 jaar oude puzzel op
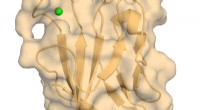
- Onderzoekers beeld atomaire structuur van belangrijke immuunregulator af
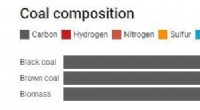
- Hoe maken we waterstof uit steenkool, en is het echt een schone brandstof?
- Nieuw upcycling-systeem voor commerciële polyesters

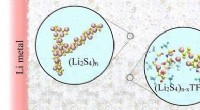
- Optimalisatie van de elektrolyten van lithium-zwavelbatterijen voor een lange levensduur
- Druk zorgt voor de beste koeling

 Gescheiden vaders worden vaak afgewezen door scholen
Gescheiden vaders worden vaak afgewezen door scholen Efficiëntere omzetting van warmte in elektriciteit door te sleutelen aan nanostructuur
Efficiëntere omzetting van warmte in elektriciteit door te sleutelen aan nanostructuur India lanceert kleine satelliet ontworpen door studenten
India lanceert kleine satelliet ontworpen door studenten Hoe veroorzaken mensen erosie?
Hoe veroorzaken mensen erosie?  Productie van biobrandstoffen:een kwestie van rijden onder invloed?
Productie van biobrandstoffen:een kwestie van rijden onder invloed?  Eiwit beëindigt opzettelijk de eigen synthese door de synthesemachinerie te destabiliseren - het ribosoom
Eiwit beëindigt opzettelijk de eigen synthese door de synthesemachinerie te destabiliseren - het ribosoom Waarom de maan zo'n kraterachtige plek is
Waarom de maan zo'n kraterachtige plek is  Optische chaos gebruiken om het momentum van licht te beheersen
Optische chaos gebruiken om het momentum van licht te beheersen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

