
Wetenschap
Onderzoekers beeld atomaire structuur van belangrijke immuunregulator af
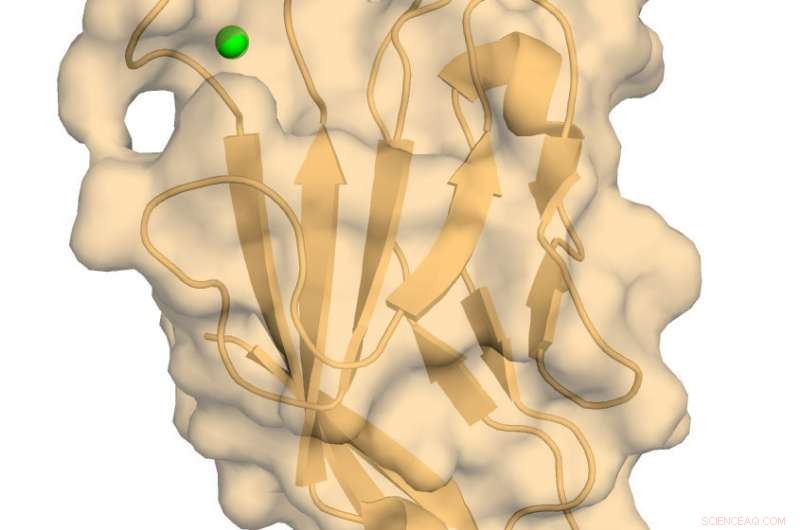
Menselijke TIM-3 met gebonden calcium. Krediet:Richard Blumberg, Brigham en het vrouwenziekenhuis
Een nieuwe studie door onderzoekers van Brigham en Women's Hospital biedt een biofysische en structurele beoordeling van een kritisch immuunregulerend eiwit dat humaan T-cel-immunoglobuline en mucine-domein bevat dat eiwit-3 (hTIM-3) bevat. Het begrijpen van de atomaire structuur van hTIM-3 biedt nieuwe inzichten voor het richten van dit eiwit op tal van kanker- en auto-immuuntherapieën die momenteel in klinische ontwikkeling zijn. De bevindingen van dit onderzoek zijn online gepubliceerd in Wetenschappelijke rapporten op 30 november.
"Het hTIM-3-eiwit is een belangrijke immuunregulator, toch was het moeilijk om zich te richten op de ontwikkeling van geneesmiddelen, omdat de conformationele details van de structuur met hoge resolutie ongrijpbaar waren, " zei senior auteur Richard Blumberg, MD, hoofd van de afdeling gastro-enterologie, Hepatologie en endoscopie op de afdeling geneeskunde van de Brigham. "We hebben de structuur van hTIM-3 opgelost en een nieuwe biochemische test opgezet om de functionaliteit ervan te definiëren, wat nuttig zal zijn om de rol van hTIM-3 in het immuunsysteem te begrijpen."
Het team heeft een röntgenkristalstructuur met hoge resolutie en een kernmagnetische resonantie (NMR) afbeelding gemaakt van het hTIM-3 IgV-domein dat betrokken is bij functionele interacties met CEACAM1, wat een cruciaal ontsnappingsmechanisme is voor veel kankers. belangrijk, het team bepaalde de precieze locatie van een calciumatoom, een essentiële co-factor, gebonden aan het hTIM-3 IgV-domein.
"Dit is de eerste NMR-analyse van een immuungerelateerd TIM-molecuul en het eerste structurele rapport met hoge resolutie van het hTIM-3 IgV-domein met associatie van kritische co-factoren zoals calcium, " zei auteur Amit Gandhi, doctoraat, een onderzoeker in het laboratorium van Blumberg bij de afdeling Geneeskunde. "Niemand heeft dit eerder kunnen doen. Hopelijk zal dit helpen bij de targeting van humaan hTIM-3 en de ontwikkeling van bruikbare therapieën."
"Deze hier getoonde structuur vertegenwoordigt een hoge resolutie, fysiologisch relevant hTIM-3-molecuul, " zei auteur Walter Kim, MD, doctoraat, een onderzoeker in het laboratorium van Blumberg en een associate arts in de afdeling Geneeskunde. "Nu kunnen we begrijpen welke specifieke regio's van het eiwit toegankelijk zijn voor therapeutische medicijnen om te binden."
 Neutronen onthullen de wilde Weyl-wereld van halfmetalen
Neutronen onthullen de wilde Weyl-wereld van halfmetalen Lost Oil Rubberhandschoenen op?
Lost Oil Rubberhandschoenen op?  Geavanceerde vingerafdruktechnologie kan helpen in de strijd tegen mescriminaliteit
Geavanceerde vingerafdruktechnologie kan helpen in de strijd tegen mescriminaliteit Uitdaging voorspelt hoe metalen met complexe vormen en fabricage zullen breken
Uitdaging voorspelt hoe metalen met complexe vormen en fabricage zullen breken Een methode om afgebroken perovskiet in zonnecellen te vervangen door ze recyclebaar te maken
Een methode om afgebroken perovskiet in zonnecellen te vervangen door ze recyclebaar te maken
Hoofdlijnen
- Zijn mannen of vrouwen gelukkiger?
- In welke levensfase komt mitose sneller voor?
- Gespecialiseerde cellen in het lichaam
- Bescherming van het wild:professor helpt recreatieverstoring voor dieren in het wild tot een minimum te beperken
- Klimaatveranderingsmodellen van vogeleffecten slagen voor de test
- Hoe bouw je een DNA-model uit tandenstokers
- Planten evolueren geuren en kleuren om dieren aan te trekken voor zaadverspreiding
- Alles in de familie:gerichte genomische vergelijkingen
- Facilitated Diffusion: Definition, Example & Factors
- Op zijde gebaseerde apparaten met antisense-miRNA-therapeutica kunnen de botregeneratie verbeteren

- Model voor op 2D materiaal gebaseerde RRAM gevonden

- Het vriespunt berekenen

- Chemiluminescentiesondes voor de snelle en gevoelige detectie van salmonella en listeria
- Wetenschappers identificeren eiwitten die mogelijk bestonden toen het leven begon
 Hoe wordt een Delta gevormd?
Hoe wordt een Delta gevormd?  Simulaties om inzicht in elektrokinetisch transport betrouwbaarder te maken
Simulaties om inzicht in elektrokinetisch transport betrouwbaarder te maken Taal kan vrouwen in wetenschap en technologie ondermijnen
Taal kan vrouwen in wetenschap en technologie ondermijnen Gigantische deeltjesversneller in de lucht
Gigantische deeltjesversneller in de lucht Bio-geïnspireerde elektromechanische nanogeneratoren om celactiviteit te reguleren
Bio-geïnspireerde elektromechanische nanogeneratoren om celactiviteit te reguleren Vita:volgende missienaam en logo van het ruimtestation
Vita:volgende missienaam en logo van het ruimtestation Meer realistisch onderzoek nodig naar stoffen die in het milieu terechtkomen
Meer realistisch onderzoek nodig naar stoffen die in het milieu terechtkomen Ruimtestraling is een riskante zaak voor het menselijk lichaam
Ruimtestraling is een riskante zaak voor het menselijk lichaam
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | German | Dutch | Danish | Norway | Swedish |

-
Wetenschap © https://nl.scienceaq.com

