
Wetenschap
Is ammoniak amfoteer volgens het bronsted lawry-concept?
Ammoniak (NH3) kan fungeren als een Bronsted-base door een proton uit een zuur te accepteren. Wanneer ammoniak bijvoorbeeld reageert met zoutzuur (HCl), vormt het ammoniumchloride (NH4Cl) en water (H2O):
NH3 + HCl → NH4+ + Cl- + H2O
Bij deze reactie accepteert ammoniak een proton uit HCl en wordt het ammoniumion (NH4+), het geconjugeerde zuur van ammoniak.
Ammoniak kan ook fungeren als een Bronsted-zuur door een proton aan een base te doneren . Wanneer ammoniak bijvoorbeeld reageert met natriumhydroxide (NaOH), vormt het natriumamide (NaNH2) en water (H2O):
NH3 + NaOH → NaNH2 + H2O
Bij deze reactie doneert ammoniak een proton aan NaOH en wordt het het amide-ion (NH2-), de geconjugeerde base van ammoniak.
Daarom is ammoniak amfoteer volgens het Bronsted-Lowry-concept omdat het zowel een proton kan doneren als accepteren.
 Onderzoekers zoeken naar de oorsprong van het zoutgehalte dat leidt tot een vermindering van de gewasopbrengst
Onderzoekers zoeken naar de oorsprong van het zoutgehalte dat leidt tot een vermindering van de gewasopbrengst Antarctisch zee-ijs beperkt de CO2-uitstoot mogelijk niet zo veel als eerder werd gedacht
Antarctisch zee-ijs beperkt de CO2-uitstoot mogelijk niet zo veel als eerder werd gedacht Van vlindervleugels tot bankbiljetten:hoe de kleuren van de natuur fraude kunnen voorkomen
Van vlindervleugels tot bankbiljetten:hoe de kleuren van de natuur fraude kunnen voorkomen  Wat zijn gedragsaanpassingen voor een boom?
Wat zijn gedragsaanpassingen voor een boom?  Kan de grootste boosdoener van de opwarming van de aarde de gewassen helpen?
Kan de grootste boosdoener van de opwarming van de aarde de gewassen helpen?
Hoofdlijnen
- Zou gigantische zeekelp de volgende bron van biobrandstof kunnen zijn?
- Wetenschappers ontwikkelen een computervisieframework om dieren in het wild te volgen zonder markeringen
- Een gedenatureerd eiwit kan zich opnieuw vormen naar zijn functionele vorm wanneer het in de normale omgeving wordt teruggebracht. Wat betekent dat voor een bevestiging?
- Hoe bacteriën fluoride bestrijden
- Auto-immuniteit kan verklaren waarom een belangrijk immuunsysteem bij veel bacteriën ontbreekt
- Wat is een tweede neef? Het ontrafelen van de stamboom
- Hoe zal klimaatverandering de arctische kariboes en rendieren beïnvloeden?
- Mexico zegt dat de bedreigde vaquita-bruinvis in gevangenschap is gestorven
- Wetenschappers werken aan een periodiek systeem voor ecologie
- De kansen zijn goed voor een unieke 2D-compound
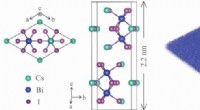
- Onderzoekers helpen bij het ontwikkelen van duurzame polymeren

- Stoffen gezichtsmaskers die kunnen worden gedesinfecteerd door zonlicht

- Ontwikkeld enzym dat PET in tien uur kan afbreken
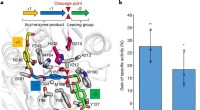
- 3D-printen creëert superzachte structuren die hersenen en longen nabootsen
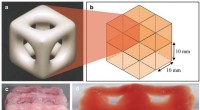
 Vermindering van luchtverontreinigende stoffen zou de opwarming van de aarde kunnen versterken zonder vermindering van broeikasgassen
Vermindering van luchtverontreinigende stoffen zou de opwarming van de aarde kunnen versterken zonder vermindering van broeikasgassen Light Spectrum Explained for Kids
Light Spectrum Explained for Kids Wat tieners zien in gesloten online ruimtes zoals de Discord-app
Wat tieners zien in gesloten online ruimtes zoals de Discord-app Wetenschappers modelleren het klimaat op Mars om de bewoonbaarheid te begrijpen
Wetenschappers modelleren het klimaat op Mars om de bewoonbaarheid te begrijpen Het principe van inkjetprinten en de toepassingen ervan op AR/VR-microdisplays
Het principe van inkjetprinten en de toepassingen ervan op AR/VR-microdisplays Wat zijn de deficiëntie-toxiciteitssymptomen van koolstof?
Wat zijn de deficiëntie-toxiciteitssymptomen van koolstof?  Plasticvervuiling in de diepzee:een geologisch perspectief
Plasticvervuiling in de diepzee:een geologisch perspectief NIST-software helpt bij de analyse van geïnstrumenteerde charpy-tests
NIST-software helpt bij de analyse van geïnstrumenteerde charpy-tests
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

