
Wetenschap
Als je zoutzuur en metaal zou gebruiken, zou de reactie dan hetzelfde zijn geweest als er zwavelzuur was gebruikt?
Reactiviteit: Zowel HCl als H2SO4 zijn sterke zuren, maar H2SO4 is een sterker zuur dan HCl. Dit betekent dat H2SO4 gemakkelijker protonen (H+) kan doneren dan HCl, wat kan leiden tot snellere reacties met metalen.
Producten: De producten van de reacties tussen HCl en metalen omvatten doorgaans waterstofgas (H2) en een metaalchloridezout. Wanneer HCl bijvoorbeeld reageert met ijzer (Fe), zijn de producten H2-gas en ijzer(II)chloride (FeCl2).
De producten van de reacties tussen H2SO4 en metalen kunnen waterstofgas (H2), een metaalsulfaatzout en water (H2O) omvatten. Wanneer H2SO4 bijvoorbeeld reageert met koper (Cu), zijn de producten H2-gas, koper(II)sulfaat (CuSO4) en water.
Corrosie: Zowel HCl als H2SO4 kunnen metalen aantasten, maar de mate van corrosie kan variëren afhankelijk van het metaal en de concentratie van het zuur. H2SO4 is over het algemeen corrosiever dan HCl vanwege de hogere zuurgraad.
Hoewel zowel HCl als H2SO4 kunnen reageren met metalen om waterstofgas en metaalzouten te produceren, kunnen de specifieke producten en de omvang van de reactie verschillen, afhankelijk van de reactiviteit van het metaal en de sterkte van het zuur.>
 Hoe een infraroodspectrofotometer te kalibreren
Hoe een infraroodspectrofotometer te kalibreren  Hoe kernfusiereactoren werken
Hoe kernfusiereactoren werken  (Re)generatie volgende:nieuwe strategie om steigers te ontwikkelen voor regeneratie van gewrichtsweefsel
(Re)generatie volgende:nieuwe strategie om steigers te ontwikkelen voor regeneratie van gewrichtsweefsel Onderzoek onthult inzichten in enzym dat een algemeen broeikasgas bestrijdt
Onderzoek onthult inzichten in enzym dat een algemeen broeikasgas bestrijdt Chemici gebruiken gemodificeerde DNA-nucleotiden om nieuwe materialen te maken
Chemici gebruiken gemodificeerde DNA-nucleotiden om nieuwe materialen te maken
 Wetenschappers ontrafelen hoe en waarom Amazonebomen sterven
Wetenschappers ontrafelen hoe en waarom Amazonebomen sterven  Onderwijs beïnvloedt de religiositeit van Amerikanen – maar niet hoe je zou denken
Onderwijs beïnvloedt de religiositeit van Amerikanen – maar niet hoe je zou denken  Minstens 304 doden, 1, 800 gewonden bij krachtige aardbeving in Haïti
Minstens 304 doden, 1, 800 gewonden bij krachtige aardbeving in Haïti Sociaal rechtvaardig bevolkingsbeleid kan klimaatverandering verminderen en mondiale rechtvaardigheid bevorderen
Sociaal rechtvaardig bevolkingsbeleid kan klimaatverandering verminderen en mondiale rechtvaardigheid bevorderen Een strijd voor zowel land als cultuur in het licht van klimaatverandering
Een strijd voor zowel land als cultuur in het licht van klimaatverandering
Hoofdlijnen
- Hoe zaden weten dat het een goed moment is om te ontkiemen
- Hoe draken werken
- Is een rode bloedcel een dierlijke of plantaardige cel?
- Hoe de tastharen van cellen worden gemaakt
- Waarom het mitochondriale genoom van sla lijkt op een gehakte salade
- De illegale schildpaddenhandel - waarom wetenschappers geheimen bewaren
- Een fossiele baby hielp wetenschappers verklaren hoe zoogdieren floreerden na het uitsterven van de dinosauriërs
- Van motief naar methode,
- Hoe grotbiologie werkt
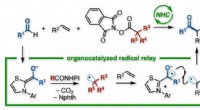
- Buurtreactie:een radicale strategie om drie organische groepen met elkaar te verbinden
- Quantum wapening:Quantum dots verbeteren de stabiliteit van perovskietkristallen die zonne-energie oogsten

- Efficiënte scheiding van glycopeptiden bereikt door grensvlakgepolymeriseerde polymeerdeeltjes
- Brandstofaërosolen die de vervuiling van het milieu verminderen

- Elektronenkristallografie bleek net zo goed te werken als röntgenkristallografie alleen op kleinere kristallen

 Een afscheid van Plutoshine
Een afscheid van Plutoshine Hoe betrouwbaar is de DNA-test van uw hond?
Hoe betrouwbaar is de DNA-test van uw hond?  Soorten organismen die fotosynthese kunnen gebruiken
Soorten organismen die fotosynthese kunnen gebruiken  Hoe heeft NASA bijgedragen aan het verbeteren van onze lucht en water?
Hoe heeft NASA bijgedragen aan het verbeteren van onze lucht en water?  Raketteam:Zijn zonne-uitbarstingen rommelig, of netjes?
Raketteam:Zijn zonne-uitbarstingen rommelig, of netjes? Hoe goed zijn testen op E. coli in beken?
Hoe goed zijn testen op E. coli in beken?  Kun je het winterweer voorspellen op basis van het zomerweer?
Kun je het winterweer voorspellen op basis van het zomerweer?  Natuurlijk driedimensionaal niet-lineair fotonisch kristal
Natuurlijk driedimensionaal niet-lineair fotonisch kristal
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

