
Wetenschap
Wat is de zuurdissociatieconstante voor een HX H X in evenwicht?
HX ⇌ H+ + X- wordt gegeven door de vergelijking:
$$Ka =\frac{[H^+][X^-]}{[HX]}$$
waarbij [H+], [X-] en [HX] respectievelijk de evenwichtsconcentraties van waterstofionen (H+), geconjugeerde base (X-) en het niet-gedissocieerde zuur (HX) vertegenwoordigen. Ka is een kwantitatieve maatstaf voor de sterkte van een zuur in oplossing, wat de neiging aangeeft om een proton (H+ ion) te doneren.
Deze vergelijking definieert de Ka voor een monoprotisch zuur, een zuur dat een enkel proton kan doneren. Voor polyprotische zuren (zuren die meerdere protonen kunnen doneren) zullen er meerdere Ka-waarden zijn, die elk overeenkomen met de dissociatie van een specifiek proton.
De waarde van Ka geeft informatie over de zuurgraad van de oplossing:
- Een hoge Ka-waarde geeft aan dat het zuur vollediger dissocieert, wat resulteert in een hogere concentratie H+-ionen en een lagere pH.
- Een kleine Ka-waarde geeft aan dat het zuur minder volledig dissocieert, wat leidt tot een lagere concentratie H+-ionen en een hogere pH.
De Ka-waarde is een karakteristieke eigenschap van een bepaald zuur en is temperatuurafhankelijk. Het wordt vaak gebruikt in de zuur-base-chemie om de sterkte van zuren te kwantificeren, de mate van dissociatie te voorspellen en verschillende berekeningen uit te voeren met betrekking tot zuur-base-evenwichten.
 Ingenieurs gebruiken Tiki-fakkels bij onderzoek naar roet, dieselfilters
Ingenieurs gebruiken Tiki-fakkels bij onderzoek naar roet, dieselfilters Procesmodellering voor efficiëntere pulp- en papierproductie
Procesmodellering voor efficiëntere pulp- en papierproductie Amerikaans aardgas exporteren? Niet zo snel, zegt Stanford-econoom
Amerikaans aardgas exporteren? Niet zo snel, zegt Stanford-econoom  De verrassende flexibiliteit van kristaloppervlakken vastleggen
De verrassende flexibiliteit van kristaloppervlakken vastleggen Cyborg-technologie kan nieuwe diagnostiek mogelijk maken, samensmelting van mens en AI
Cyborg-technologie kan nieuwe diagnostiek mogelijk maken, samensmelting van mens en AI
 Gevaren van mijnafval benadrukt in VN-rapport
Gevaren van mijnafval benadrukt in VN-rapport Waarom de natuurlijke oplossingen van UNESCO voor waterproblemen niet werken in Afrika
Waarom de natuurlijke oplossingen van UNESCO voor waterproblemen niet werken in Afrika De biodiversiteit op aarde:wat weten we en waar gaan we heen?
De biodiversiteit op aarde:wat weten we en waar gaan we heen?  NASA analyseert tropische storm Lowells zeer koude wolkentoppen
NASA analyseert tropische storm Lowells zeer koude wolkentoppen Meer evacuaties nu massale branden zich snel uitbreiden in Californië
Meer evacuaties nu massale branden zich snel uitbreiden in Californië
Hoofdlijnen
- Regulering van CO2 in het lichaam
- Hadeda ibissen zesde zintuig werkt het beste op natte grond:nieuw onderzoek is een wake-up call voor het voortbestaan van waadvogels
- Een muis of een olifant:welke soort bestrijdt infecties effectiever?
- Wat zijn de negen menselijke systemen?
- Unieke stemafdrukken bij papegaaien kunnen ervoor zorgen dat vogels als een kudde worden herkend, wat ze ook zeggen
- Onderzoek bij vogels suggereert dat de leermethode invloed heeft op de manier waarop de hersenen neuronen toevoegen
- Zal deze cel langer worden tijdens de mitose?
- Waarom wordt magnesiumchloride gebruikt in PCR?
- De bijen redden? Daar is een app voor
- De computationele methoden van onderzoekers maken de weg vrij voor de volgende generatie membraantechnologie voor waterzuivering

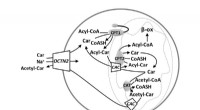
- OCTN:een transporter met relevantie voor menselijke pathofysiologie, ontdekking en diagnostiek van geneesmiddelen
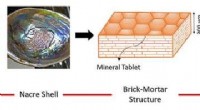
- Ontwikkeling van multifunctionele composietmaterialen voor ruimtevaarttoepassingen
- Geheimen van Lucretia schilderij dichter bij onthulling

- Elektrostatische kracht neemt de leiding in bio-geïnspireerde polymeren

 Wetenschapsprojecten over het scheiden van olie en water
Wetenschapsprojecten over het scheiden van olie en water Geweld tegen vrouwen in de videogame Red Dead Redemption 2 roept giftige mannelijkheid op
Geweld tegen vrouwen in de videogame Red Dead Redemption 2 roept giftige mannelijkheid op In het verlengde van de trend, 2017 was het op één na warmste jaar ooit
In het verlengde van de trend, 2017 was het op één na warmste jaar ooit El Nino schommelt heftiger in het industriële tijdperk, overtuigend hard bewijs zegt:
El Nino schommelt heftiger in het industriële tijdperk, overtuigend hard bewijs zegt: Nieuwe inzichten in de materie van neutronensterren
Nieuwe inzichten in de materie van neutronensterren Wat gebeurt er als een stuk koperdraad in het buitenste vlamgebied wordt verwarmd tot het roodgloeiend is?
Wat gebeurt er als een stuk koperdraad in het buitenste vlamgebied wordt verwarmd tot het roodgloeiend is?  Klimaatverandering verslechtert extreem weer in Australië:wetenschappers
Klimaatverandering verslechtert extreem weer in Australië:wetenschappers Hoe komt chloor in zoetwaterbronnen terecht?
Hoe komt chloor in zoetwaterbronnen terecht?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

