Wetenschap
Volgens de VSPER-theorie zullen de buitenste atomen in een eenvoudig molecuul zo gerangschikt zijn dat?
Over het algemeen zullen de elektronenparen een configuratie aannemen die de afstand tussen hen maximaliseert, wat resulteert in de meest stabiele moleculaire structuur. In een molecuul met vier elektronenparen is de tetraëdrische geometrie bijvoorbeeld de meest stabiele opstelling, waarbij de vier elektronenparen op de hoeken van een tetraëder zijn geplaatst en van elkaar af wijzen. In een molecuul met drie elektronenparen is de trigonale vlakke geometrie het meest stabiel, waarbij de drie elektronenparen op de hoeken van een gelijkzijdige driehoek zijn geplaatst, waardoor de afstand tussen de elektronenparen opnieuw wordt gemaximaliseerd.
De VSEPR-theorie stelt ons in staat de moleculaire geometrie en vorm van eenvoudige moleculen te voorspellen door het aantal en het type elektronenparen rond het centrale atoom te beschouwen en de opstelling te bepalen die de afstoting van elektronenparen minimaliseert.
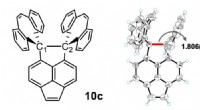
 De eerste cellen zijn mogelijk ontstaan omdat bouwstenen van eiwitten membranen stabiliseerden
De eerste cellen zijn mogelijk ontstaan omdat bouwstenen van eiwitten membranen stabiliseerden Nieuw onderzoek laat zien hoe gebonden materialen, van vliegtuigvleugels tot tandkronen, hun hechting verliezen
Nieuw onderzoek laat zien hoe gebonden materialen, van vliegtuigvleugels tot tandkronen, hun hechting verliezen  Hoe droog je abrikozen met zwavel?
Hoe droog je abrikozen met zwavel?  Waarom neemt de elektronegativiteit afwisselend toe en af in de boorfamilie?
Waarom neemt de elektronegativiteit afwisselend toe en af in de boorfamilie?  Wat is de definitie van semi-synthetisch polymeer?
Wat is de definitie van semi-synthetisch polymeer?
Hoofdlijnen
- Machine learning kan wetenschappers helpen begrijpen waarom vogels plastic eten
- Eiwitarm dieet in het vroege leven verlengt de levensduur van fruitvliegen
- Relatie tussen DNA en natuurlijke selectie
- Van vervelende beestjes tot goede larven:Amerikanen tonen interesse in alternatieve, duurzame eiwitten
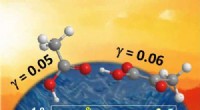
- Wat zijn de intermoleculaire krachten tussen honing?
- Onderzoekers bestuderen hoe zingende vleermuizen communiceren
- 'Junk'-wetenschap? Voor sommige krabben doet de grootte er in ieder geval toe
- Wat is ATP en welk deel van de cel wordt er door gemaakt?
- Vogelgriep gedetecteerd bij wilde vogels in New York City
 Vogels onthullen het belang van goede buren voor gezondheid en veroudering
Vogels onthullen het belang van goede buren voor gezondheid en veroudering Hoe gelijktijdige recordbrekende hittegolven die Antarctica en het noordpoolgebied raken, gevolgen zullen hebben voor dieren in het wild
Hoe gelijktijdige recordbrekende hittegolven die Antarctica en het noordpoolgebied raken, gevolgen zullen hebben voor dieren in het wild De wetenschap zegt:waarom sommige vliegtuigen niet vliegen bij hoge hitte
De wetenschap zegt:waarom sommige vliegtuigen niet vliegen bij hoge hitte  Carbon voetbal met extra proton waarschijnlijk de meest voorkomende vorm in de ruimte
Carbon voetbal met extra proton waarschijnlijk de meest voorkomende vorm in de ruimte NASA analyseert orkaan Harveys regenval, ziet aanlanding
NASA analyseert orkaan Harveys regenval, ziet aanlanding Wat maakt een goede werkhond? Een 'bekwaamheidstest' voor honden kan aanwijzingen bieden
Wat maakt een goede werkhond? Een 'bekwaamheidstest' voor honden kan aanwijzingen bieden  Bots waren niet erg actief op Twitter tijdens de Finse gemeenteraadsverkiezingen
Bots waren niet erg actief op Twitter tijdens de Finse gemeenteraadsverkiezingen Ernst van Noord-Pacific stormen op hoogste punt in meer dan 1, 200 jaar
Ernst van Noord-Pacific stormen op hoogste punt in meer dan 1, 200 jaar
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com