
Wetenschap
Wat gebeurt er als een zuur aan een base wordt toegevoegd?
De algemene chemische vergelijking voor neutralisatie is:
```
Zuur + Base → Zout + Water
```
Wanneer bijvoorbeeld zoutzuur (HCl) wordt toegevoegd aan natriumhydroxide (NaOH), vindt de volgende reactie plaats:
```
HCl + NaOH → NaCl + H2O
```
Bij deze reactie combineren de waterstofionen uit HCl met de hydroxide-ionen uit NaOH om water te vormen, terwijl de natriumionen (Na+) uit NaOH zich combineren met de chloride-ionen (Cl-) uit HCl om natriumchloride (NaCl) te vormen.
Neutralisatiereacties zijn belangrijk in veel alledaagse toepassingen, zoals:
* Zuur-base titraties , die worden gebruikt om de concentratie van een onbekend zuur of onbekende base te bepalen.
* De productie van zouten , zoals natriumchloride (keukenzout) en kaliumnitraat (gebruikt in meststoffen).
* De behandeling van brandend maagzuur , die wordt veroorzaakt door overtollig maagzuur. Antacida, dit zijn basen, kunnen maagzuur neutraliseren en verlichting bieden bij brandend maagzuur.
Ook in het milieu zijn neutralisatiereacties belangrijk. Ze helpen bijvoorbeeld bij het reguleren van de pH van natuurlijk water, zoals meren en rivieren. Als de pH van een waterlichaam te zuur wordt, kan dit schadelijk zijn voor het waterleven. Neutralisatiereacties kunnen helpen de pH-balans van waterlichamen te herstellen en aquatische ecosystemen te beschermen.
 Ontbossing die de meeste soorten ter wereld in gevaar brengt, zegt nieuw wereldwijd onderzoek
Ontbossing die de meeste soorten ter wereld in gevaar brengt, zegt nieuw wereldwijd onderzoek Onderzoek onthult het verband tussen klimaatverandering, El Niño en de mogelijkheid voor meer extreme bosbranden
Onderzoek onthult het verband tussen klimaatverandering, El Niño en de mogelijkheid voor meer extreme bosbranden De stormen worden erger. Wat betekent dat voor onze gezondheid?
De stormen worden erger. Wat betekent dat voor onze gezondheid?  Wat is de levensduur van de House Spider?
Wat is de levensduur van de House Spider?  Eerste bewijs dat de klok tikt op Britse landbouwgronden
Eerste bewijs dat de klok tikt op Britse landbouwgronden
Hoofdlijnen
- Nieuwe studie toont aan dat cannabis het geheugen van oudere muizen verhoogt
- Hoe leeftijdsgebonden genetische afwijkingen bijdragen aan het leeftijdseffect van de moeder
- Een vaccin voor eetbare planten? nieuwe gewasbeschermingsmethode in zicht
- Onderzoekers verduidelijken hoe cellen zichzelf verdedigen tegen virussen
- Soorten monomeren
- Hypertonische versus hypotonische oplossingen:verschillen en toepassingen
- Naam voor de functie van een organisme?
- Hoe diep leven organismen in de zee?
- Nieuwe krachtdetectiemethode onthult hoe cellen weefselstijfheid waarnemen
- Betere metaaloxiden om de groene eigenschappen van veel energietoepassingen te stimuleren
- Kankergebonden enzymmechanisme nieuw gekarakteriseerd in studie
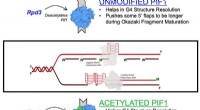
- Onderzoekers rapporteren eerste 3D-structuur van DHHC-enzymen
- Nieuwe studie:stikstof vormt zeer ongebruikelijke structuren onder hoge druk

- Efficiënte perovskiet-zonnecellen ontwikkeld door interface-gemedieerde recombinatie te verminderen
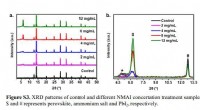
 Temperatuur, zonnestraling, wind-parameters om de luchttemperatuur van een voertuig in de cabine te voorspellen
Temperatuur, zonnestraling, wind-parameters om de luchttemperatuur van een voertuig in de cabine te voorspellen Hoe het volume te berekenen op STP
Hoe het volume te berekenen op STP Kleine wervelingen spelen een grote rol bij het voeden van microben in de oceaan
Kleine wervelingen spelen een grote rol bij het voeden van microben in de oceaan Het verschil tussen eb en vloed
Het verschil tussen eb en vloed ECOSTRESS onder wetenschappelijke ladingen op volgende ruimtestationmissie
ECOSTRESS onder wetenschappelijke ladingen op volgende ruimtestationmissie Heldere röntgen galactische kernen
Heldere röntgen galactische kernen Nieuwe interventies om de studieresultaten en het gedrag van studenten te verbeteren
Nieuwe interventies om de studieresultaten en het gedrag van studenten te verbeteren Russisch vliegtuig in dodelijk vuur vond wereldwijd weinig klanten
Russisch vliegtuig in dodelijk vuur vond wereldwijd weinig klanten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

