Wetenschap
Kankergebonden enzymmechanisme nieuw gekarakteriseerd in studie
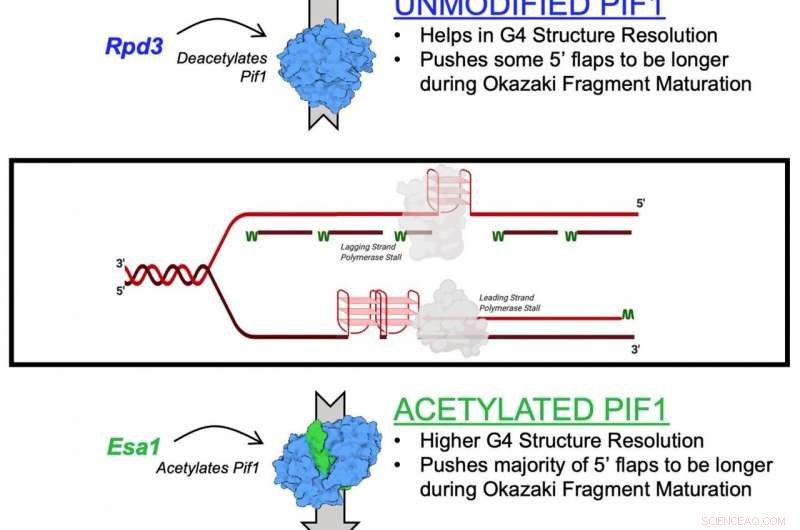
Een diagram dat de acetylering van het Pif1-helicase-enzym illustreert Credit:Matthew Bochman en Lata Balakrishnan, Indiana University Bloomington/IUPUI
Een nieuwe studie onder leiding van wetenschappers van IUPUI en Indiana University Bloomington is de eerste die een biochemisch mechanisme beschrijft dat de activiteit verhoogt van een molecuul waarvan de aanwezigheid bij veel soorten kanker wordt waargenomen.
het molecuul, een enzym genaamd Pif1helicase, speelt een rol bij veel belangrijke cellulaire processen in het lichaam. Een strikte regulering van dit eiwit is van vitaal belang voor de stabiliteit van het genoom, omdat te weinig of te veel activiteit veroudering en ouderdomsziekten kan beïnvloeden. voornamelijk kanker. Een veel voorkomende kankertherapie, HDAC-remmers, kan ook een piek in dit enzym veroorzaken.
"Momenteel, we geven mensen medicijnen die de Pif-activiteit verhogen zonder volledig te weten hoe het andere delen van de cel beïnvloedt die een rol spelen bij de stabiliteit van het genoom, " zei Lata Balakrishnan, een universitair hoofddocent biologie aan de School of Science bij IUPUI, wie is co-hoofdauteur van het onderzoek.
"HDAC-remmers reguleren bepaalde tumoronderdrukkingsgenen, en worden daarom gebruikt in combinatietherapieën om specifieke kankers te behandelen, maar als het gaat om hun impact op andere delen van de cel, we opereren eigenlijk in het donker."
De andere hoofdauteur van de studie is Matthew Bochman, een universitair hoofddocent aan de afdeling moleculaire en cellulaire biochemie van het IU Bloomington College of Arts and Sciences. Andere co-auteurs zijn Christopher Sausen en Onyekachi E. Ononye, doctoraat studenten in de laboratoria van Bochman en Balakrishnan, respectievelijk, op het moment van de studie.
Het in de studie beschreven mechanisme is het effect van lysineacetylering op Pif1. Lysine-acetylering vindt plaats wanneer een klein molecuul, een acetylgroep genaamd, zich bindt aan lysine, een aminozuur dat wordt gebruikt om gemeenschappelijke eiwitten in het lichaam op te bouwen. Deze actie transformeert lysine van een positief geladen molecuul in een neutraal geladen molecuul. Deze neutralisatie kan de eiwitfunctie beïnvloeden, eiwitstabiliteit en eiwit-eiwit interactie in cellen, onder andere.
Helicases staan bekend als de genetische "ritsen" van cellen omdat ze DNA uit elkaar trekken met het oog op genetische replicatie en reparatie. Ze helpen ook om telomeren te behouden, de structuur aan het einde van chromosomen die korter wordt naarmate mensen ouder worden.
In de nieuwe studie de onderzoekers identificeerden lysine-acetylering op Pif1-helicase en toonden aan dat de toevoeging van de acetylgroep de activiteit van het eiwit verhoogt, evenals de "uitpakkende" functie. Ze ontdekten ook dat lysineacetylering de vorm - of "conformatie" - van het Pif1-eiwit verandert. Ze geloven dat deze vormverandering de hoeveelheid Pif1-helicase verhoogt.
"Het dynamische samenspel van de toevoeging en verwijdering van de acetylgroep op lysine reguleert een grote verscheidenheid aan eiwitten in de cel, " zei Balakrishnan. "Verstoringen van dit proces kunnen een rol spelen bij kanker, veroudering, ontstekingsreacties en zelfs verslavingsgerelateerd gedrag."
"Als een klas, helicasen zijn betrokken bij veel processen die nodig zijn voor genoomintegriteit, " Bochman toegevoegd. "Elke significante storing in deze processen is over het algemeen kankerverwekkend."
De precieze details van lysine-acetylering in Pif1, het effect van de vorm van het enzym en de resulterende impact op de helicase-activiteit duurde bijna vijf jaar om te observeren en te rapporteren. De studie, parallel uitgevoerd op twee IU-campussen, werd mogelijk gemaakt door de complementaire expertise van de leidende wetenschappers. Als biochemicus die eerder lysine-acetylering in andere eiwitten heeft bestudeerd, Balakrishnan was in staat om Pif1 in vitro te isoleren om zijn reactie op chemische reacties in een reageerbuis te observeren. In tegenstelling tot, als geneticus die in gist werkt als een modelorganisme om Pif1 te bestuderen Bochman was in staat om cellen in vivo te modificeren om reacties te zien plaatsvinden in een levend organisme.
"Het vermogen om deze reacties in een levende cel te observeren is vaak relevanter, maar het is ook veel rommeliger, "Zei Balakrishnan. "Onze experimenten informeerden elkaar voortdurend waar we heen moesten."
Kijkend naar de toekomst, Bochman zei dat ingewikkelde kennis van cellulaire processen - zoals lysineacetylering - in toenemende mate een rol zal spelen bij gepersonaliseerde therapie.
"Als je de tumor van een patiënt sequentieert, u kunt medicijnen afstemmen op zeer specifieke enzymen, " zei hij. "In plaats van een medicijn dat in grote lijnen de hele cel aantast, het zal mogelijk zijn om een gerichte aanpak te volgen die mogelijke bijwerkingen vermindert. Dit niveau van personalisatie is echt de toekomst van kankerbiologie en kankergeneeskunde."
 Dieren en planten die op bergen leven
Dieren en planten die op bergen leven Meer dan 80% van de overblijfselen van het Atlantisch regenwoud is aangetast door menselijke activiteit
Meer dan 80% van de overblijfselen van het Atlantisch regenwoud is aangetast door menselijke activiteit Kristallen helpen vulkanen om met druk om te gaan
Kristallen helpen vulkanen om met druk om te gaan Opschaling van inspanningen om bossen te herstellen
Opschaling van inspanningen om bossen te herstellen Verkeerde migraties zorgen ervoor dat schelpdieren niet kunnen ontsnappen aan de opwarming van de oceaan
Verkeerde migraties zorgen ervoor dat schelpdieren niet kunnen ontsnappen aan de opwarming van de oceaan
Hoofdlijnen
- Het bestuderen van circadiane ritmes in planten en hun ziekteverwekkers kan leiden tot precisiegeneeskunde voor mensen
- De Saguaro Cactus is een iconisch symbool van het Amerikaanse zuidwesten
- Onderzoekers verwachten dat nieuwe vispassage de trekvispopulaties zal herstellen
- Tekenen kunnen helpen, kunnen geschiedenisliefhebbers helpen om meer buff te krijgen
- Het veredelen van zeer productieve maïs heeft zijn aanpassingsvermogen verminderd
- Exon: definitie, functie en belang in RNA Splicing
- Hoe een 3D-diercelmodel te maken
- Ontmoet Afrika's vogelmeester van vocale imitatie
- Celkarakteristieken
 Boeings onrustige 737 MAX krijgt enorme vertrouwensstemming van IAG
Boeings onrustige 737 MAX krijgt enorme vertrouwensstemming van IAG Objecten die Sound
Objecten die Sound Video:NASA's Artemis-astronaut Victor Glover
Video:NASA's Artemis-astronaut Victor Glover Een eenvoudige laser voor kwantumachtig klassiek licht
Een eenvoudige laser voor kwantumachtig klassiek licht Koolstof nanobuisspons toont verbeterde waterzuivering
Koolstof nanobuisspons toont verbeterde waterzuivering Nieuw onderzoek werpt licht op hoe de internationale gemeenschap de stabiliteit in post-conflictgebieden kan handhaven
Nieuw onderzoek werpt licht op hoe de internationale gemeenschap de stabiliteit in post-conflictgebieden kan handhaven Astronomen deden eerste metingen van kleinschalige rimpelingen in oerwaterstofgas met behulp van zeldzame dubbele quasars
Astronomen deden eerste metingen van kleinschalige rimpelingen in oerwaterstofgas met behulp van zeldzame dubbele quasars Brandweerlieden proberen relikwieën te redden terwijl het Rio-museum door brand wordt overspoeld
Brandweerlieden proberen relikwieën te redden terwijl het Rio-museum door brand wordt overspoeld
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com