
Wetenschap
Wat is het verschil tussen een zwak en een sterk zuur? Het vermogen van zuren om wat te doen?
Dissocieert slechts in geringe mate in water en slechts een klein deel van de zuurmoleculen produceert waterstofionen.
Een zwak zuur heeft een zwak donerend vermogen.
Bijv.:azijnzuur (CH3COOH)
Sterk zuur: Dissocieert volledig in water en vormt waterstofionen en geconjugeerde base.
Produceert een veel hoge concentratie waterstofionen.
Een sterk zuur heeft een hoog donerend vermogen.
Bv.:zoutzuur (Hcl), salpeterzuur (HNO3)
Het verschil:
- Mate van dissociatie:Zwakke zuren dissociëren slechts gedeeltelijk, terwijl sterke zuren volledig dissociëren.
- Evenwicht:Zwakke zuren bereiken een evenwichtstoestand waarin zowel gedissocieerde als niet-gedissocieerde moleculen naast elkaar bestaan, terwijl sterke zuren volledig dissociëren en er geen niet-gedissocieerde moleculen achterblijven.
- Waterstofionenconcentratie:Zwakke zuren produceren een lagere concentratie waterstofionen vergeleken met sterke zuren bij dezelfde concentratie.
- pH-waarde:Oplossingen van zwakke zuren hebben een hogere pH-waarde dan oplossingen van sterke zuren bij dezelfde concentratie.
- Corrosiviteit:Sterke zuren zijn over het algemeen corrosiever dan zwakke zuren vanwege hun hoge waterstofionenconcentratie.
- Reactiviteit:Sterke zuren zijn reactiever en nemen gemakkelijker deel aan chemische reacties vanwege hun hogere concentratie waterstofionen.
 Vissen naar één slechte cel uit triljoenen goede
Vissen naar één slechte cel uit triljoenen goede Radioactief afval:waar moet het naartoe?
Radioactief afval:waar moet het naartoe?  Wat zijn de kleuren van een vuur en hoe heet zijn ze?
Wat zijn de kleuren van een vuur en hoe heet zijn ze?  De uiteindelijke massa van het watervrije kopersulfaat zal zijn?
De uiteindelijke massa van het watervrije kopersulfaat zal zijn?  Wiskundige methoden helpen verklaren waarom vloeibare metalen enorm verschillende breekpunten hebben
Wiskundige methoden helpen verklaren waarom vloeibare metalen enorm verschillende breekpunten hebben
Hoofdlijnen
- Doden lindebomen bijen?
- Uit nieuw onderzoek blijkt dat bioluminescentie vaker voorkomt dan eerder werd gedacht bij diepzeegarnalen
- Nieuwe studie toont overdracht van epigenetisch geheugen over meerdere generaties
- Uit onderzoek blijkt dat het verlies van grote herbivoren de interacties tussen planten en hun natuurlijke vijanden beïnvloedt
- Hoe bacteriën hun onzichtbaarheidsmantels hechten aan het immuunsysteem
- Wat is de belangrijkste factor die de synthese van duizenden verschillende eiwitten mogelijk maakt?
- Wat is een levend organisme dat met uitsterven wordt bedreigd in zijn gehele of een aanzienlijk deel van zijn verspreidingsgebied?
- Schippers dumpen afval in de wateren van Zuid-Florida? Tieners worden beschuldigd van misdrijf
- Een winterslaap houdt het vermogen om insuline te reguleren beperkt tot acht eiwitten
- Nieuwe techniek belooft verbeterde detectie van uitgezaaide prostaatkanker
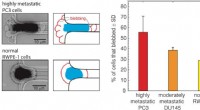
- Onderzoekers leggen in realtime rondzwervende moleculaire fragmenten vast

- Onderzoeksdoorbraak kan technologie voor schone energie transformeren

- Nieuwe technologie kan antivirusantilichamen in 20 minuten detecteren

- Röntgenverstrooiing en moleculaire dynamica-simulaties die worden gebruikt om realtime beeldvorming van oxidatie van nanodeeltjes te maken

 Hoe Taiwan erin slaagde zijn dodental zo laag te houden tijdens de aardbeving met een kracht van 7,4
Hoe Taiwan erin slaagde zijn dodental zo laag te houden tijdens de aardbeving met een kracht van 7,4  Onderzoekers die plantensoorten catalogiseren proberen te ontcijferen wat sommige groepen zo succesvol maakt
Onderzoekers die plantensoorten catalogiseren proberen te ontcijferen wat sommige groepen zo succesvol maakt  Hoe klimaatverandering en invasieve soorten boomkikkers bedreigen
Hoe klimaatverandering en invasieve soorten boomkikkers bedreigen  Wiskundig model verklaart waarom sommige bacteriën zelfs in kleine doses ziekten veroorzaken
Wiskundig model verklaart waarom sommige bacteriën zelfs in kleine doses ziekten veroorzaken  Archeologen vinden 27 doodskisten in de Egyptische piramide van Saqqara
Archeologen vinden 27 doodskisten in de Egyptische piramide van Saqqara Gamers kennen de kracht van flow:wat als leerlingen het ook zouden kunnen benutten?
Gamers kennen de kracht van flow:wat als leerlingen het ook zouden kunnen benutten? Let the Games begin:Netflix brengt eerste Indiase serie uit
Let the Games begin:Netflix brengt eerste Indiase serie uit Een nieuw testbed voor niet-evenwichtige veellichamenfysica
Een nieuw testbed voor niet-evenwichtige veellichamenfysica
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

