
Wetenschap
Waarom beschrijft deze verklaring een alternatieve theorie van zuren en basen?
Deze theorie is gebaseerd op het concept van elektronenparen en chemische bindingen, in plaats van op het traditionele concept van waterstofionen (H+) en hydroxide-ionen (OH-) zoals gedefinieerd door de Arrhenius-theorie.
In de Lewis-theorie wordt een zuur-base-reactie gezien als de overdracht van een elektronenpaar van de base naar het zuur. Het zuur, dat elektronendeficiënt is, accepteert het elektronenpaar van de base, die elektronenrijk is. Dit resulteert in de vorming van een covalente binding tussen het zuur en de base.
Enkele voorbeelden van zuren en basen volgens de Lewis-theorie zijn onder meer:
- Zuren:BF3, AlCl3, H+, CO2, SO3
- Basen:NH3, H2O, OH-, CH3COO-, pyridine
De Lewis-theorie is vooral nuttig bij het begrijpen van het gedrag van zuren en basen in niet-waterige oplosmiddelen, waar de traditionele Arrhenius-theorie mogelijk niet toepasbaar is. Het biedt ook een algemener raamwerk voor het begrijpen van zuur-base-reacties, aangezien het een breder scala aan reacties omvat dan de Arrhenius-theorie.
Ondanks het nut van de Lewis-theorie wordt de Arrhenius-theorie nog steeds veel gebruikt, vooral in inleidende scheikundecursussen, vanwege de eenvoud ervan en de focus op het gedrag van zuren en basen in waterige oplossingen.
 Kunstmatige intelligentie werpt licht op membraanprestaties
Kunstmatige intelligentie werpt licht op membraanprestaties Hoe heeft de wetenschap de vervuiling geholpen?
Hoe heeft de wetenschap de vervuiling geholpen?  Is Na2CO2 ionisch of covalent?
Is Na2CO2 ionisch of covalent?  Zeer efficiënt, duurzame elektrokatalysator om de productie van waterstofbrandstof te stimuleren
Zeer efficiënt, duurzame elektrokatalysator om de productie van waterstofbrandstof te stimuleren Wetenschappers visualiseren de structuur van een sleutelenzym dat triglyceriden maakt
Wetenschappers visualiseren de structuur van een sleutelenzym dat triglyceriden maakt
 Klimaatverandering kan giftige algenbloei in onze oceanen dodelijker maken
Klimaatverandering kan giftige algenbloei in onze oceanen dodelijker maken Indringende vraag:Wat betekent 'bedrijfscultuur'?
Indringende vraag:Wat betekent 'bedrijfscultuur'?  Het nitraatprobleem van de landbouw laten verdwijnen in de lucht
Het nitraatprobleem van de landbouw laten verdwijnen in de lucht China is een hotspot van ozonvervuiling op leefniveau
China is een hotspot van ozonvervuiling op leefniveau Overstappen op een groene afvalwaterinfrastructuur kan de uitstoot verminderen en enorme besparingen opleveren, zo blijkt uit nieuw onderzoek
Overstappen op een groene afvalwaterinfrastructuur kan de uitstoot verminderen en enorme besparingen opleveren, zo blijkt uit nieuw onderzoek
Hoofdlijnen
- Leven in drijfhout in zee:het geval van drijfhoutspecialist talitrids
- Databank voor larvale vissen om de effecten van klimaatverandering op de visserij te laten zien
- Lost in translation:hoe 'risicovolle' aminozuren de eiwitsynthese van de verlenging afbreken
- Inside story:hoe de Russen de e-mails van de Democraten hackten
- Hoe geneest een kikker een gewonde huid zonder littekens?
- De illegale schildpaddenhandel - waarom wetenschappers geheimen bewaren
- Van Alaska tot Amazonia:de eerste wereldwijde kaarten met eigenschappen die de groei van vegetatie stimuleren
- Uit welke elementen bestaat glucose?
- Het ontsluiten van de genetische blauwdruk van appels:vorm- en maatkenmerken onthuld
- Wetenschappers construeren zeer sterke microbuis door coaxiaal printen met aangepaste biohybird hydrogel-inkt

- Nieuwe bevindingen werpen licht op de ontwikkeling van op liposomen gebaseerde remmers
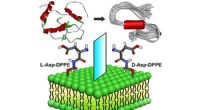
- Wetenschappers creëren een nieuwe elektronegativiteitsschaal

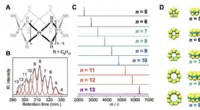
- Een reactie op preparatieve schaal met behulp van platinaclusters met een gerealiseerde eencijferige atomiciteit
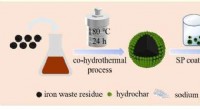
- Wetenschappers gebruiken tabaksafvalvloeistof en ijzerafval voor het verwijderen van Cd(II)
 De elektrische voertuigrevolutie zal uit China komen, niet de VS
De elektrische voertuigrevolutie zal uit China komen, niet de VS Bizar donkere vloeistof met negatieve massa zou het universum kunnen domineren
Bizar donkere vloeistof met negatieve massa zou het universum kunnen domineren Designerpeptiden tonen potentieel voor het blokkeren van virussen en moedigen toekomstig onderzoek aan
Designerpeptiden tonen potentieel voor het blokkeren van virussen en moedigen toekomstig onderzoek aan  Doorbreken van de absorptielimiet van silicium in de richting van het korte-golflengte-infraroodgolflengtebereik via spanningstechniek
Doorbreken van de absorptielimiet van silicium in de richting van het korte-golflengte-infraroodgolflengtebereik via spanningstechniek Wiskundigen stellen de beroemde Battle of Britain wat als scenario's op de proef
Wiskundigen stellen de beroemde Battle of Britain wat als scenario's op de proef De betekenis van de strijdwagen:de Tarotkaart van de Grote Arcana begrijpen
De betekenis van de strijdwagen:de Tarotkaart van de Grote Arcana begrijpen  Politieke oriëntatie voorspelt wetenschappelijke ontkenning:gevolgen voor Amerikanen die worden gevaccineerd
Politieke oriëntatie voorspelt wetenschappelijke ontkenning:gevolgen voor Amerikanen die worden gevaccineerd Techniek om de elektrische potentiaalverdeling in composietelektroden van lithium-ionbatterijen in vaste toestand te karakteriseren
Techniek om de elektrische potentiaalverdeling in composietelektroden van lithium-ionbatterijen in vaste toestand te karakteriseren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

