
Wetenschap
Waarom is de oppervlaktespanning van water hoger dan die van methaan?
Waterstofbinding is een dipool-dipoolinteractie die plaatsvindt tussen sterk elektronegatieve atomen (zoals zuurstof of stikstof) en waterstofatomen gebonden aan deze elektronegatieve atomen. In water zijn de zuurstofatomen in het molecuul gedeeltelijk negatief vanwege hun hoge elektronegativiteit, terwijl de waterstofatomen gedeeltelijk positief zijn. Door deze polariteit kunnen watermoleculen sterke waterstofbruggen vormen met naburige moleculen, waardoor een samenhangend netwerk ontstaat.
Watermoleculen aan het oppervlak ervaren een onbalans van intermoleculaire krachten. Aan de ene kant zijn ze gebonden aan andere watermoleculen in de vloeistof, terwijl de andere kant wordt blootgesteld aan lucht of een andere niet-mengbare vloeistof. De sterke waterstofbruggen tussen watermoleculen aan het oppervlak trekken ze dichter bij elkaar, waardoor het oppervlak wordt geminimaliseerd en de interactie van water met de omgeving wordt verminderd. Dit cohesieve gedrag resulteert in een hogere oppervlaktespanning voor water.
Methaan is daarentegen een niet-polair molecuul, wat betekent dat de elektronen gelijkmatig verdeeld zijn en dat er binnen het molecuul geen significant verschil in elektronegativiteit bestaat. Als gevolg hiervan missen methaanmoleculen het vermogen om sterke waterstofbruggen met elkaar te vormen. De intermoleculaire krachten in methaan zijn voornamelijk Londense dispersiekrachten, dit zijn zwakke aantrekkingskrachten die voortkomen uit de tijdelijke fluctuaties in de elektronendichtheid.
由于甲烷分子之间的范德华力较弱,甲烷的表面张力小于水。
Daarom leidt de afwezigheid van sterke intermoleculaire krachten in methaan tot een zwakker cohesiegedrag aan het oppervlak. Methaanmoleculen ervaren zwakkere Van der Waals-krachten, die onvoldoende zijn om het oppervlak zo stevig bij elkaar te houden als in het geval van water. Dit resulteert in een lagere oppervlaktespanning voor methaan vergeleken met water.
Samenvattend is de hoge oppervlaktespanning van water een gevolg van de sterke waterstofbinding tussen de moleculen, waardoor een samenhangend netwerk ontstaat en de interactie van water met de omgeving wordt geminimaliseerd. Aan de andere kant mist methaan deze sterke intermoleculaire krachten, wat leidt tot een lagere oppervlaktespanning als gevolg van zwakkere van der Waals-krachten.
 Nieuwe chemie voor het regelen van het vloeistofvolume in volumetrische additieve productie
Nieuwe chemie voor het regelen van het vloeistofvolume in volumetrische additieve productie COVID-19-antilichaamtesten:hoe betrouwbaar zijn ze?
COVID-19-antilichaamtesten:hoe betrouwbaar zijn ze? Verschillen van natriumhydroxide versus Natriumcarbonaat
Verschillen van natriumhydroxide versus Natriumcarbonaat Waarom verbranden ijs en zout de huid?
Waarom verbranden ijs en zout de huid?  Waarom krijgen sommige atomen elektronen en andere verliezen tijdens ionische binding?
Waarom krijgen sommige atomen elektronen en andere verliezen tijdens ionische binding?
 Model laat zien hoe plankton overleeft in een turbulente wereld
Model laat zien hoe plankton overleeft in een turbulente wereld  Canadese energieregulator geeft knipoog naar Pacific-pijpleiding
Canadese energieregulator geeft knipoog naar Pacific-pijpleiding Afbeelding:Kyoto en Osaka
Afbeelding:Kyoto en Osaka Studie werpt nieuw licht op hoe jonge boomzaailingen zich ontwikkelen
Studie werpt nieuw licht op hoe jonge boomzaailingen zich ontwikkelen  De eerste COVID-19 lockdowns verbeterden de luchtkwaliteit. Waar zijn we een jaar later?
De eerste COVID-19 lockdowns verbeterden de luchtkwaliteit. Waar zijn we een jaar later?
Hoofdlijnen
- Onderzoekers op zoek naar inzicht in hoe verschillende geslachten zich voor het eerst ontwikkelden
- Onderzoekers onderzoeken de impact van verhoogde CO₂-concentratie op subtropische bomen
- Uit onderzoek blijkt dat Beluga-walvissen veranderen wat ze eten als gevolg van de klimaatverandering
- Wetenschappers onderzoeken hoe verschillende vloeibare organellen in cellen worden gecreëerd
- Hoe bacteriën 'zelfvaccineren' tegen virale indringers
- Europese mollen kunnen in de winter met een tiende krimpen om energie te besparen
- Hoe het Jeruzalem-syndroom werkt
- Hoe Facebook kraakt over nepnieuws (en waarom nepnieuws werkt)
- Experimenten tonen aan dat de gegevens over het vroege leven volledig 'vals-positieven' kunnen zijn
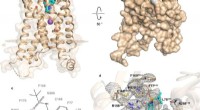
- Studie onthult structuur van receptor die betrokken is bij diabetes type 2 en meer
- Mobiel apparaat kan het gemakkelijker maken om schadelijke algenbloei te voorspellen en te beheersen

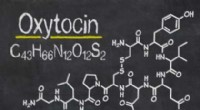
- Wetenschappers creëren een liefdesmolecuul met minder complicaties
- Poreuze materialen meten temperatuur op moleculair niveau

- Zou een fytochemische stof afkomstig van groenten zoals broccoli het antwoord kunnen zijn op antibioticaresistente ziekteverwekkers?

 Hoe een vorm te beschrijven in termen van zijn gebied en perimeter
Hoe een vorm te beschrijven in termen van zijn gebied en perimeter  Onderzoek onthult hoe polymeren ontspannen na stressvolle verwerking
Onderzoek onthult hoe polymeren ontspannen na stressvolle verwerking Wat zijn de bronnen van het Amazone-regenwoud?
Wat zijn de bronnen van het Amazone-regenwoud?  Wildvuur in Nieuw-Zeeland zal naar verwachting wekenlang branden
Wildvuur in Nieuw-Zeeland zal naar verwachting wekenlang branden Is dit lichtpuntje een exoplaneet?
Is dit lichtpuntje een exoplaneet?  Nostalgie is niet meer wat het was
Nostalgie is niet meer wat het was  Minerale coatings kunnen houdbare mRNA-therapieën mogelijk maken
Minerale coatings kunnen houdbare mRNA-therapieën mogelijk maken  Dodelijke vervuiling hoog in 2020 ondanks lockdowns
Dodelijke vervuiling hoog in 2020 ondanks lockdowns
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

